AcuCort är ett läkemedelsbolag som utvecklat Zeqmelit®, ett läkemedel som nu är i kommersialiseringsfas. Zeqmelit® är en munfilm baserad på kortisonsubstansen dexametason, för snabb tillgänglighet och lindring vid bland annat svåra och akuta allergiska reaktioner. Zeqmelit® är godkänt i Sverige, Danmark, Norge och Finland, och målet är global kommersialisering i EU, USA och på utvalda nyckelmarknader via licenstagare och distributörer. AcuCort bildades år 2006 och har huvudkontor i Lund. Bolaget är noterat på Spotlight Stock Market sedan år 2017. Under Q3-24 lanserades Zeqmelit® på apotek i Sverige, Norge och Finland, vilket följdes av en geografisk expansion till Danmark under Q2-25.
Pressmeddelanden
Nya orders, LOI:er och regulatoriska framsteg i samspel
AcuCort AB (”AcuCort” eller ”Bolaget”) är ett läkemedelsbolag som utvecklat Zeqmelit®, en innovativ munfilm baserad på kortisonsubstansen dexametason för snabb och effektiv behandling av akuta allergiska reaktioner. Under Q2-25 accelererade Bolagets kommersiella resa, vilket understryks av två strategiskt viktiga LOI:er med Lunatus i Mellanöstern och Glenmark Pharmaceuticals i Europa, återkommande orders från Unimedic Pharma samt inträdet på den danska marknaden. Därtill erhölls återkoppling från FDA avseende Bolagets iPSP-ansökan, vilket skapar förutsättningar för en NDA-ansökan under H2-25. Med en stärkt balansräkning efter emissionen i Q1-25 och optionsinlösen i Q3-25 står AcuCort väl rustat för ett händelserikt H2-25, där fortsatt kommersiellt momentum, potentiella partnerskap och regulatoriska framsteg förväntas utgöra centrala triggers. Genom en DCF- och rNPV-värdering, med en applicerad WACC om 12 %, härleds ett riskjusterat nuvärde (börsvärde) om ca 259 MSEK (256) i ett Base scenario, motsvarande 1,1 kr (1,1) per aktie.
- Avsiktsförklaringar med betydande potential
Under Q2-25 tog AcuCort viktiga steg mot en internationell expansion genom två strategiskt viktiga avsiktsförklaringar (LOI) avseende distribution och marknadsföring av Zeqmelit®. Det första LOI:et slöts med Lunatus, ett välrenommerat läkemedelsbolag baserat i Dubai, vilket har potential att ge AcuCort en kapitaleffektiv väg in på marknaderna i Mellanöstern och Gulfstaterna. Kort därefter tecknades ett LOI med Glenmark Pharmaceuticals, en global aktör med närvaro i över 80 länder och en årsomsättning om ca 15 mdSEK. Avtalet omfattar sex europeiska marknader, däribland Tyskland, med en samlad befolkning överstigande 160 miljoner. Glenmarks regulatoriska kompetens, finansiella muskler och breda distributionskapa-citet gör bolaget till en attraktiv partner. LOI:erna markerar inledande steg mot bindande avtal, och positiva utfall av de pågående Due Diligence-processerna utgör därmed betydande värdedrivare att bevaka under H2-25.
- Återkoppling från FDA avseende iPSP-ansökan
AcuCort tog under kvartalet ett viktigt steg i den regulatoriska processen på den amerikanska marknaden genom att erhålla återkoppling från FDA på Bolagets Initial Pediatric Study Plan (iPSP). Detta är ett obligatoriskt moment inför en formell NDA-ansökan och i förlängningen ett potentiellt marknadsgodkännande i USA. Ansökan (iPSP) lämnades in i slutet av Q4-24, men den normalt 90 dagar långa granskningen har fördröjts av interna processer hos FDA. AcuCort arbetar nu med att adressera de frågor som lyfts, och under antagandet att inga ytterligare förseningar uppstår bedömer vi att en NDA-ansökan kan lämnas in mot slutet av H2-25, en potentiellt avgörande katalysator för AcuCorts inträde på den amerikanska marknaden.
- Fortsatt attraktiv Risk/Reward
I samband med Q2-rapporten gör vi mindre justeringar avseende år 2025. Genom en DCF- och rNPV-värdering samt en WACC om 12 % härleds ett riskjusterat nuvärde (EV) om ca 225 MSEK. Justerat för nettokassan om 34,1 MSEK härleds ett nuvärdesberäknat börsvärde om ca 259 MSEK, motsvarande 1,1 kr per aktie.
9
Värdedrivare
1
Historisk lönsamhet
8
Ledning & Styrelse
6
Riskprofil
Samtliga analyser av bolag från och med år 2020 betygssätts utifrån ett nytt betygssystem - Värdedrivare, Historisk Lönsamhet och Ledning & Styrelse sträcker sig från 1 till 10, där 10 är högsta betyg. Riskprofil sträcker sig från 1 till 10, där 10 är att anse som högst risk. Aktieanalyser av bolag publicerade innan 2020 har betygssatts utifrån en annan modell.
Starka triggers i närtid
Med en framgångsrik företrädesemission i ryggen, som tillförde AcuCort AB (”AcuCort” eller ”Bolaget”) ca 43,4 MSEK, står Bolaget väl positionerat att ta nästa kliv i den kommersiella utvecklingen. Som ett led i denna utveckling för Bolaget nu ett flertal långtgående dialoger med potentiella distributions- och licenspartners på detaljnivå, bl.a. i Tyskland, Frankrike och Storbritannien. De två nyligen erhållna uppföljningsorderna från Unimedic Pharma, varav en markerar inträdet på den danska marknaden, utgör ytterligare ett kvitto på den växande efterfrågan på Zeqmelit®. Med en rad värdedrivande triggers framgent, däribland ytterligare uppföljningsorders i Norden, regulatoriska framsteg och potentiella samarbetsavtal, väntar ett händelserikt år 2025 med goda förutsättningar för fortsatt kommersiell framgång. Genom en DCF- och rNPV-värdering, samt en WACC om 11,8 % härleds ett riskjusterat nuvärde (börsvärde) om ca 256 MSEK (233) i ett Base scenario, motsvarande 1,1 kr (1,0) per aktie.
- Zeqmelit® tar klivet in i Danmark genom ny order
Inledningen av Q2-25 präglades av en ny order på Zeqmelit® från Unimedic Pharma till ett värde om ca 18,5 tEUR. Ordern utgör startskottet för den kommande lanseringen i Danmark under juni månad och markerar nästa steg i Bolagets nordiska etablering. Även om orderns monetära omfattning är begränsad, väger det strategiska värdet desto tyngre. Vidare mottogs ytterligare en order i maj om ca 60,4 tEUR, vilket markerar den tredje i ordningen. Dessa ordrar signalerar att Zeqmelit® vinner fäste på marknaden och stärker samtidigt vår tes om att den nordiska hemmamarknaden antas agera som en central språngbräda för AcuCorts globala kommersialiseringssatsning.
- Kommersiellt fokus med avtal i sikte
Kapitaltillskottet om ca 43,4 MSEK från den fulltecknade företrädesemissionen har stärkt AcuCorts finansiella position och möjliggör en mer offensiv kommersialiseringsstrategi framgent. Bolaget rapporterar om långtgående diskussioner med potentiella distributions- och licenspartners, särskilt på de europeiska nyckelmarknaderna Tyskland, Frankrike och Storbritannien. Det primära fokuset ligger i nuläget på att ingå konkreta avtal i Europa, men dialoger förs även på utvalda marknader såsom Kina, Indien, Australien, samt i USA, där en iPSP lämnades in till FDA under Q4-24. Granskningsprocessen avseende iPSP har dock fördröjts något till följd av interna hanteringsrutiner vid FDA, men målsättningen är fortsatt att lämna in en fullständig NDA-ansökan innan årets slut.
- Betydande triggers förväntas synliggöra potentialen
Analyst Group ser fortsatt goda förutsättningar för att AcuCort, under kommande kvartal, kan ingå lukrativa samarbetsavtal som successivt synliggör det underliggande värdet i Zeqmelit® och affärsmodellen i stort. Med en solid balansräkning, en bred pipeline av fördjupade partnerdialoger och potentiella uppföljningsorders, bedömer vi att Bolaget är väl positionerat. Vi vidhåller våra prognoser, och genom en DCF- och rNPV-värdering samt en WACC om 11,8 % härleds ett riskjusterat nuvärde (EV) om ca 200 MSEK. Justerat för nettokassan om 38,4 MSEK härleds ett nuvärdesberäknat börsvärde om ca 256 MSEK, motsvarande 1,1 kr per aktie.
9
Värdedrivare
1
Historisk lönsamhet
7
Ledning & Styrelse
6
Riskprofil
Samtliga analyser av bolag från och med år 2020 betygssätts utifrån ett nytt betygssystem - Värdedrivare, Historisk Lönsamhet och Ledning & Styrelse sträcker sig från 1 till 10, där 10 är högsta betyg. Riskprofil sträcker sig från 1 till 10, där 10 är att anse som högst risk. Aktieanalyser av bolag publicerade innan 2020 har betygssatts utifrån en annan modell.
Kommersiellt genombrott i sikte
Med en välfylld kassa efter en framgångsrik emission, flera pågående dialoger med möjliga samarbetspartners och allergisäsongen runt hörnet, står AcuCort AB (”AcuCort” eller ”Bolaget”) väl positionerat för nästa steg i kommersialiseringsresan. Kapitaltillskottet om ca 41 MSEK från emissionen under Q1-25 möjliggör en accelererad process för marknadsgodkännanden och fördjupade diskussioner med distributions- och licenspartners inom EU, USA och RoW. Med flera värdedrivande katalysatorer framgent, däribland förväntade uppföljningsorder från Unimedic Pharma, regulatoriska framsteg och strategiska samarbetsavtal, går AcuCort in i ett händelserikt år 2025 med betydande triggers. Genom en DCF- och rNPV-värdering, samt en WACC om 11,8 % härleds ett riskjusterat nuvärde (börsvärde) om ca 233 MSEK (223) i ett Base scenario, motsvarande 1,0 kr (1,0) per aktie.
- Kraftigt övertecknad emission möjliggör global expansion
AcuCort har nyligen genomfört en kraftigt övertecknad företrädesemission med en teckningsgrad om hela 160,6 %, vilket resulterar i en nettolikvid om ca 41,1 MSEK. De omfattande teckningsåtagandena från styrelse, VD och större aktieägare i emissionen signalerar även ett starkt förtroende för Bolagets långsiktiga potential. Optionsinlösen av serie TO2 under Q2-25 kan tillföra Bolaget ytterligare 23,8 MSEK vid full teckning, vilket skulle stärka balansräkningen ytterligare. Med en robust finansiell ställning är AcuCort väl positionerat för att kapitalisera på den ökande efterfrågan, accelerera regulatoriska processer och intensifiera samarbeten med potentiella partners inom EU, USA och RoW, vilket Analyst Group ser som tydliga triggers under H1-25.
- Tydlig strategi för global kommersialisering
Det säkrade tillväxtkapitalet skapar förutsättningar för en accelererad internationell expansion, där AcuCort förväntas intensifiera de regulatoriska processerna inom EU, USA och utvalda RoW-marknader. I slutet av Q4-24 lämnade Bolaget in en Initial Pediatric Study Plan (iPSP) till FDA, vilket banar väg för en fullständig NDA-ansökan under H2-25. Parallellt förs långt gångna diskussioner med potentiella distributions- och licenspartners på strategiskt viktiga läkemedelsmarknader såsom Tyskland, Frankrike, Storbritannien, USA samt Australien, Kina, Indien, Sydamerika och Sydafrika. Med Zeqmelit®:s tydliga patientfördelar, som adresserar ett tydligt behov på den globala allergimarknaden och en balansräkning som möjliggör ett opportunistiskt agerande, bedömer Analyst Group att AcuCort har goda förutsättningar att säkra lukrativa avtal under år 2025, en katalysator som förväntas skapa betydande aktieägarvärde.
- Väl positionerat för att realisera affärspotentialen
Med en välfylld kassa, en stark pipeline av långt gångna affärsdialoger med potential att omvandlas till konkreta avtal samt en stundande allergisäsong som förväntas driva efterfrågan på Zeqmelit®, är AcuCort väl positionerat inför år 2025. Genom en DCF- och rNPV-värdering samt en WACC om 11,8 % härleds ett riskjusterat nuvärde (EV) om 192 MSEK. Justerat för den estimerade nettokassan som följer av emissionen (40,8 MSEK) härleds ett nuvärdesberäknat börsvärde om ca 233 MSEK, motsvarande 1,0 kr per aktie.
9
Värdedrivare
1
Historisk lönsamhet
7
Ledning & Styrelse
6
Riskprofil
Samtliga analyser av bolag från och med år 2020 betygssätts utifrån ett nytt betygssystem - Värdedrivare, Historisk Lönsamhet och Ledning & Styrelse sträcker sig från 1 till 10, där 10 är högsta betyg. Riskprofil sträcker sig från 1 till 10, där 10 är att anse som högst risk. Aktieanalyser av bolag publicerade innan 2020 har betygssatts utifrån en annan modell.
Tillväxtkapital möjliggör internationell expansion
AcuCort AB (”AcuCort” eller ”Bolaget”) har under Q3-24 tagit viktiga steg i kommersialiseringsresan, där försäljningsstarten av Zeqmelit® i Sverige, Finland och Norge utgör en tydlig höjdpunkt. Efter utgången av Q3-24 tillkännagav AcuCort avsikten att genomföra en företrädesemission om ca 48 MSEK för att finansiera internationell expansion och strategiska tillväxtinitiativ, såsom förhandlingar med licens- och distributionspartners samt regulatoriska processer. Vidare har Bolaget under och efter Q3-24 erhållit varumärkesskydd i USA, beviljats förlängd SME-status från EMA, medverkat på den vetenskapliga konferensen ISPOR, och samtliga patienter har genomgått Fas IV-studien. Genom en DCF- och rNPV-modell, en WACC om 12,3 % och en estimerad teckningsgrad om 100 % i emissionen, härleds ett riskjusterat nuvärde (börsvärde) om ca 223 MSEK (169) i ett Base scenario, motsvarande 1,0 kr per aktie.
- Lansering av Zeqmelit® på nordiska hemmamarknader
Under kvartalet lanserades Zeqmelit® på apotek i Sverige, Norge och Finland, vilket återspeglas i nettoomsättningen om 0,7 MSEK under Q3-24. Försäljning och marknadsföring han-teras av distributionspartnern Unimedic Pharma, en aktör med en stark meritlista inom läkemedelslanseringar och omfattande marknadskännedom i Norden och norra Europa. Analyst Group anser att det strategiska samarbetet skapar gynnsamma förutsättningar för en framgångsrik etablering på de nordiska huvudmarknaderna, vilket även förväntas fungera som en språngbräda för framtida internationell expansion.
- Företrädesemission förväntas skapa finansiell flexibilitet
Efter utgången av Q3-24 annonserades en företrädesemission av aktier och teckningsoptioner som, vid full teckning, kan tillföra Bolaget ca 48 MSEK respektive 24 MSEK före emissionskostnader. Teckningsåtaganden från ledning, styrelse och större ägare uppgår till ca 31 %, motsvarande ca 15 MSEK. Värt att notera är att VD och styrelseordföranden avser teckna aktier för ytterligare ca 0,9 MSEK respektive 0,2 MSEK utöver sina pro rata-andelar, vilket inger förtroende och skapar incita-ment för långsiktigt aktieägarvärde, särskilt då VD avser teckna för totalt ca 1 MSEK. Emissionslikviden avses allokeras till strategiska initiativ i syfte att accelerera resan mot ett globalt kommersiellt genombrott, genom finansiering av diskussioner med potentiella partners och licenstagare i USA, EU och RoW samt regulatoriska processer. Analyst Group bedömer att kapitalanskaffningen stärker Bolagets finansiella kapacitet, vilket är essentiellt för att exekvera på den ökade efterfrågan och förbättra förhandlingspositionen med potentiella licenstagare.
- Attraktiv Risk/Reward framgent
Analyst Group estimerar en teckningsgrad om 100 % i emissionen, vilket skulle resultera i ca 95,3 miljoner nyemitterade aktier, motsvarande totalt ca 214,5 miljoner utestående aktier efter emissionen. Genom en DCF- och rNPV-modell samt en WACC om 12,3 % härleds ett riskjusterat nuvärde (EV) om 175 MSEK. Justerat för den estimerade nettokassan som följer av emissionen (48 MSEK) härleds ett nuvärdesberäknat börsvärde om ca 223 MSEK, motsvarande 1,0 kr per aktie. Se s. 5 för en mer detaljerad förklaring.
8
Värdedrivare
1
Historisk lönsamhet
7
Ledning & Styrelse
6
Riskprofil
Samtliga analyser av bolag från och med år 2020 betygssätts utifrån ett nytt betygssystem - Värdedrivare, Historisk Lönsamhet och Ledning & Styrelse sträcker sig från 1 till 10, där 10 är högsta betyg. Riskprofil sträcker sig från 1 till 10, där 10 är att anse som högst risk. Aktieanalyser av bolag publicerade innan 2020 har betygssatts utifrån en annan modell.
Försäljningsstart av Zeqmelit® runt hörnet
AcuCort AB (”AcuCort” eller ”Bolaget”) har presenterat en Q2-rapport där mycket kretsar kring den stundande lanseringen av Zeqmelit® på svenska apotek, vilket planeras ske under inledningen av september månad. Under Q2-24 har Bolaget gjort fortsatta framsteg avseende Fas 4-studien som avses nyttjas i marknadsföringssyfte samt för att erhålla godkännande från TLV avseende högkostnadsskyddet. Vidare har artiklar publicerats i vetenskapliga tidskrifter, vilka bl.a. betonar den betydande efterfrågan samt höga betalningsviljan för Zeqmelit®. Tillsammans med distributionspartnern Unimedic Pharma är Bolaget nu redo att skörda frukterna av det intensiva arbetet för kommersialisering, där den nordiska lanseringen är början på en händelserik höst. Genom en DCF-modell för den nordiska marknaden samt en rNPV-modell för EU- och USA-marknaderna, tillsammans med en applicerad diskonteringsränta om 12,6 %, härleds ett riskjusterat nuvärde om ca 169 MSEK (132) i ett Base scenario, motsvarande 1,4 kr (1,1) per aktie.
- Fullrekryterad Fas 4-studie löper enligt plan
En viktig beståndsdel i det intensiva prelanseringsarbetet som fortlöpt under Q2-24 är Fas 4-studien (ZEQ001), vilken blev fullrekryterad i maj (50 patienter), och löper därmed enligt plan. Trots att studien inte är nödvändig för kommersialiseringen av Zeqmelit®, bedömer Analyst Group att positiva resultat kan användas som ett starkt marknadsföringsverktyg för att nå ut till Bolagets huvudsakliga målgrupp, astma- och allergiläkare. Vidare förväntas resultaten från studien utgöra ett viktigt beslutsunderlag för TLV avseende högkostnadsskyddet, vilket, vid ett positivt beslut, skulle kunna öka marknadspotentialen ytterligare.
- Studie vittnar om god betalningsvilja för Zeqmelit®
Under Q2-24 har två studier, baserade på den enkätstudie som AcuCort genomförde år 2022 om hur allergipatienter värderar sin behandling, publicerats i internationella vetenskapliga tidskrifter. I studiens andra del framkommer bl.a. att behandling med självupplösande munfilm har ett värde för patienterna som överstiger traditionell tablettbehandling med 574 kr, vilket kan ställas i relation till AcuCorts planerade pris för Zeqmelit® om 300 kr per förpackning med två munfilmer. Analyst Group bedömer att dessa publikationer kan öka kännedomen om produkten och validera den starka efterfrågan, vilket är viktiga pusselbitar för att attrahera potentiella kommersialiseringspartners och främja en framgångsrik marknadsintroduktion.
- Reviderat värderingsintervall
Den andra halvan av år 2024 förväntas bjuda på ett smörgåsbord av triggers, där den kommande nordiska lanseringen, resultat från Fas 4-studien, en potentiell NDA-ansökan samt beslut från TLV utgör intressanta händelser som kan bidra till ökat aktieägarvärde. Med en reviderad diskonteringsränta härleds ett motiverat riskjusterat nuvärde om ca 169 MSEK (132) i ett Base scenario, motsvarande 1,4 kr (1,1) per aktie.
7
Värdedrivare
1
Historisk lönsamhet
7
Ledning & Styrelse
6
Riskprofil
Samtliga analyser av bolag från och med år 2020 betygssätts utifrån ett nytt betygssystem - Värdedrivare, Historisk Lönsamhet och Ledning & Styrelse sträcker sig från 1 till 10, där 10 är högsta betyg. Riskprofil sträcker sig från 1 till 10, där 10 är att anse som högst risk. Aktieanalyser av bolag publicerade innan 2020 har betygssatts utifrån en annan modell.
Inleder kommersialisering inom Norden
En historisk milstolpe har realiserats då AcuCort AB (”AcuCort” eller ”Bolaget”) har erhållit en första order på munfilmen Zeqmelit, och Bolaget övergår därmed från vision till realitet i termer av kommersialisering. Parallellt med lanseringen i Norden, fortgår aktiviteter för marknadsgodkännande på övriga målmarknader, där Bolaget bl.a. förväntas formalisera en NDA-ansökan under H2-24. En framgångsrik lansering inom Norden är en vital komponent, dels för att erhålla uppföljande ordrar från Unimedic Pharma, dels för att säkra framtida avtal med potentiella partners, där USA utgör en viktig och lukrativ marknad. Baserat på utfallet av optionsinlösen, där ca 35 miljoner aktier tillkom, justeras vårt motiverade värde per aktie i ett Base scenario till 1,1 kr (1,2), motsvarande ett nuvärde om 132 MSEK (147).
- Inleder kommersiell fas på den nordiska marknaden
Under februari erhöll Bolaget en första order från Unimedic Pharma uppgående till ca 0,8 MSEK, vilken förväntas täcka den initiala efterfrågan för den inledande lanseringen. Ordern kommer att redovisas som en intäkt under Q2-24, och givet en framgångsrik lansering förväntas Bolaget erhålla uppföljande beställningar. Produktionskapaciteten är sedan tidigare säkrad och Zeqmelit förväntas nå de nordiska apoteken under sommaren 2024. Analyst Group anser att Bolaget är väl rustat för en framgångsrik lansering genom att proaktivt ha produktionspartner på plats och med hjälp av munfilmens uppenbara patientfördelar samt en väletablerad distributionspartner som har omfattande nätverk och starka finansiella resurser.
- Optionsinlösen stärker kassan efter kvartalets utgång
Efter utgången av Q1-24 har AcuCort tillförts ca 14,1 MSEK före emissionskostnader genom optionsinlösen. Kapitalinjektionen stärker kassan och skapar utökat finansiellt spelrum, särskilt då AcuCort avser att strategiskt vara anpassningsbara och opportunistiska utifrån marknaden, då bl.a. due diligence- samt juridiska kostnader snabbt kan sätta press på likviditeten.
- Solid kostnadskontroll
De totala rörelsekostnaderna uppgick till 4,7 MSEK (4,4) under Q1-24, motsvarande en ökning om ca 8 % Y-Y. Kommersialiseringen har medfört ökade kostnader, hänförligt till bl.a. regulatoriska konsulter och fas 4-studien. Trots detta uppvisar AcuCort en solid kostnadskontroll, vilket återspeglas i en kostnadsreduktion om ca 2 MSEK Q-Q, samt att kostnaderna var i linje med Q3-23. Kostnadsbasen estimeras öka gradvis, för att under helåret 2024 uppgå till ca 24 MSEK.
- Triggers i närtid
Kommande kvartal bjuder på flertalet triggers, där bl.a. ett besked från TLV avseende prissubventionering förväntas under H1-24. Med den initiala ordern på plats, utrullning inom Norden och ett annalkande besked från TLV, samt en potentiell NDA-ansökan under H2-24, bedömer Analyst Group att 2024 kommer att bli ett transformativt år, fyllt av intressanta händelser som kan bidra till ökat aktieägarvärde.
7
Värdedrivare
1
Historisk lönsamhet
7
Ledning & Styrelse
6
Riskprofil
Samtliga analyser av bolag från och med år 2020 betygssätts utifrån ett nytt betygssystem - Värdedrivare, Historisk Lönsamhet och Ledning & Styrelse sträcker sig från 1 till 10, där 10 är högsta betyg. Riskprofil sträcker sig från 1 till 10, där 10 är att anse som högst risk. Aktieanalyser av bolag publicerade innan 2020 har betygssatts utifrån en annan modell.
Ett säljande läkemedelsbolag
AcuCort AB (”AcuCort” eller ”Bolaget”) har under februari mottagit sin första kommersiella order av Zeqmelit och innebär därmed att AcuCort är ett säljande läkemedelsbolag. Produktionskapaciteten är sedan tidigare säkerställd och AcuCort har tagit fram en produktionsplan, i syfte att framgångsrikt kunna leverera på den förväntade efterfrågan. I samband med att AcuCort blir ett säljande läkemedelsbolag motiverar detta enligt oss en högre värdering, något vi inte anser återspeglas i det rådande bolagsvärdet om 34 MSEK. Den första order kan utgöra ett startskott i aktien vad gäller uppvärdering, varför vi i samband med denna analysuppdatering upprepar vårt motiverade värde om 147 MSEK, motsvarande 1,7 kr per aktie, i ett Base scenario för AcuCort.
- Har erhållit första ordern
AcuCort skrev i sin Q4-rapport att den första kommersiella ordern bedöms komma från Unimedic Pharma under Q1-24, vilket också blev fallet den 27 februari. Ordervärdet framgår ej men förväntas ha stor positiv påverkan på resultatet. Detta är en mycket viktig milstolpe i AcuCorts historia och innebär därmed att Bolaget tagit klivit från att vara ett utvecklingsbolag till att bli ett kommersiellt läkemedelsbolag. Under H1-24 förväntas även ett besked från Tandvårds- och läkemedelsförmånverket (TLV) gällande potentiell subvention av Zeqmelit®, där ett potentiellt godkännande skulle bädda för en starkare försäljning i Sverige då slutkonsumenter kan omfattas av högkostnadsskyddet vilket därmed möjliggör ett lägre pris.
- Stark balansräkning inför kommersialiseringen
Vid utgången av december 2023 uppgick kassan till 19,2 MSEK, vilket motsvarar en ökning om 12,2 MSEK mot föregående kvartal, drivet av genomförd företrädesemission under kvartalet. Under 2023 har AcuCort uppvisat en genomsnittlig kapitalförbrukning, s.k. burn rate, om ca 1 MSEK/månad och under antagandet att AcuCort utvecklas med en liknande kapitalförbrukning framgent, skulle AcuCort vara finansierade under hela år 2024, allt annat lika. Dock kommer den påbörjade försäljningsresan troligen resultera i något stigande kostnader initialt, vilket vi dock bedömer att Bolaget ska klara av. Dessutom kan AcuCort komma att tillföras ytterligare 14 MSEK via TO1 under mars i år, vilket därmed skulle förlänga kassalikviden ytterligare.
- AcuCort står inför ett högintressant år
Vi anser att AcuCort har tagit fortsatt viktiga operativa kliv framåt under det gångna kvartalet, men även under inledningen av 2024, dels genom erhållandet av partihandelstillståndet, dels genom initieringen av fas 4-studien. Med också den första kommersiella ordern bekräftad, nya varumärkes-skydd säkrade, stundande besked från såväl TLV avseende prissubventionering som FDA avseende marknadsgodkännande, anser Analyst Group att 2024 blir ett högintressant år att följa.
7
Värdedrivare
1
Historisk lönsamhet
6
Ledning & Styrelse
6
Riskprofil
Samtliga analyser av bolag från och med år 2020 betygssätts utifrån ett nytt betygssystem - Värdedrivare, Historisk Lönsamhet och Ledning & Styrelse sträcker sig från 1 till 10, där 10 är högsta betyg. Riskprofil sträcker sig från 1 till 10, där 10 är att anse som högst risk. Aktieanalyser av bolag publicerade innan 2020 har betygssatts utifrån en annan modell.
Ser ut att bli ett spännande 2024
AcuCort AB (”AcuCort” eller ”Bolaget”) har nyligen presenterat sin Q3-rapport och dessförinnan avslutat sin företrädesemission. Delårsrapporten innehöll inga direkta överraskningar och under årets sista veckor lägger AcuCort ett stort fokus på att driva processen med FDA framåt, såväl som att förbereda produktionen och marknadsföringsaktiviteter för kommersialiseringen av Zeqmelit. Baserat på utfallet i företrädesemissionen, där ca 53 miljoner aktier tillkom, justeras vårt värde per aktie i ett Base scenario till 1,7 kr (1,4). Detta är dock en teknisk justering då vi behåller vårt tidigare motiverade nuvärde om 147 MSEK (147) för AcuCort.
- Påfylld kassa och attraktivt prissatt teckningsoption
AcuCort tillfördes 21 MSEK före emissionskostnader och utifrån utfallet emitterades även ca 35 miljoner teckningsoptioner vilka berättigar innehavaren till att teckna en (1) ny aktie i AcuCort för 0,40 kr under mars 2024. Per analysens datum handlas AcuCorts aktie omkring 0,40 kr varför TO1 således i princip är in the money idag. Det är dock fyra månader kvar tills teckningsperioden och med hänsyn till de värdedrivare vi ser kan inträffa under denna tid så finns det utrymme för att AcuCorts aktie står i en högre kurs än vad den gör idag – vilket därmed kan ge en intressant affärsmöjlighet för optionsinnehavarna.
- God kostnadskontroll och stabil finansiell position
Under Q3-23 uppgick Bolagets totala rörelsekostnader till 4,8 MSEK (4,6), vilket är en ökning om endast 5 % mot Q3-22, varför vi anser att AcuCort fortsätter att uppvisa en god kostnadskontroll i rörelsen. Vid utgången av Q3-23 uppgick kassan till 7 MSEK och med hänsyn till den tillkommande nettolikviden från den efterföljande företrädesemissionen uppskattar vi att AcuCorts kassa vid utgången av oktober uppgick till omkring 23 MSEK. Givet ett antagande om en kapitalförbrukning framgent om 1,5 MSEK/månad, skulle AcuCort vara finansierade tills slutet av år 2024, allt annat lika. Med det sagt kan dock AcuCort komma att tillföras ytterligare 14 MSEK under mars 2024 via TO1, vilket därmed skulle förlänga kassalikviden ytterligare. Med hänsyn till detta anser vi att AcuCort i dagsläget har en mycket god finansiell position.
- Blickar med spänning över andra sidan Atlanten
AcuCort befinner sig bland annat i dialog med den amerikanska läkemedelsmyndigheten FDA om godkännande för Zeqmelit i USA, vilket tillsammans med ytterligare kommersiella partners som Bolaget avser att ingå avtal med skulle kunna accelerera kommersialiseringen av Zeqmelit än mer. Den nuvarande kommersialiseringen, vilken initialt väntas ta plats i Norden, ses som essentiell för att generera ett snabbt positivt kassaflöde och således erhålla mer utrymme för tillväxtsatsningar.
7
Värdedrivare
1
Historisk lönsamhet
6
Ledning & Styrelse
6
Riskprofil
Samtliga analyser av bolag från och med år 2020 betygssätts utifrån ett nytt betygssystem - Värdedrivare, Historisk Lönsamhet och Ledning & Styrelse sträcker sig från 1 till 10, där 10 är högsta betyg. Riskprofil sträcker sig från 1 till 10, där 10 är att anse som högst risk. Aktieanalyser av bolag publicerade innan 2020 har betygssatts utifrån en annan modell.
Påbörjar kommersialisering
AcuCort AB (”AcuCort” eller ”Bolaget”) har nyligen ingått ett kommersialiseringsavtal med det svenska specialist-läkemedelsföretaget Unimedic Pharma, vilka avser att ta Bolagets produkt till marknaden i de fyra stora nordiska länderna. Genom att stå för försäljnings- samt marknadsföringsinsatser i Norden väntas Unimedic Pharma agera som en essentiell kommersiell partner som potentiellt kan realisera det underliggande värdet i Zeqmelit. AcuCort väntas ha möjlighet att kapitalisera på avtalet med Unimedic Pharma till följd av erhållna marknadsgodkännanden för Zeqmelit, vilka Bolaget har erhållit i de fyra stora nordiska länderna, varför Analyst Group ser en fortsatt god uppsida i aktien. Utifrån nuvarande estimat samt tillämpade värderingsantaganden i denna analysuppdatering höjer vi vårt motiverade riskjusterade Market Cap (nuvärde) till 147 MSEK (138). Med hänsyn till den kapitalstruktur som kommer att gälla efter att den pågående företrädesemissionen avklarats, där vi antar full teckning, översätts detta till ett motiverat värde per aktie om 1,4 kr. Detta är i termer av värde per aktie lägre än i vår analys från i maj, vilket dock enbart är en teknisk justering till följd av ett ökat antal aktier efter företrädesemissionen, då vi som nämnt höjer vårt motiverade nuvärde i absoluta tal för AcuCort.
- Erhåller etikgodkännande för studie beträffande Zeqmelit
I juli meddelade AcuCort att Bolaget erhållit godkännande att starta studien ZEQ001. Syftet med studien är att utvärdera Zeqmelit vid akut allergisk reaktion och är en del av den kommande kommersialiseringen i Norden. Vidare kommer studien ge information om tillgänglighet, trygghet med behandlingen, samt upplevd effekt hos patienterna. Analyst Group ser studien som ett viktigt kliv då den bedöms generera värdefulla data-punkter vilka förväntas öka sannolikheten för en lyckad kommersialisering.
- Emissionslikvid väntas accelerera uppskalningen
Under slutet av augusti meddelade Bolaget avsikten att genomföra en företrädesemission under oktober, vilken vid full teckning estimeras tillföra Bolaget cirka 25 MSEK efter emissionskostnader. Likviden från emissionen är främst öronmärkt för att finansiera godkännandeprocessen hos FDA samt finansiering av ytterligare kommersialiseringsinsatser på andra marknader där en lansering ligger nära till hands.
- Ett flertal värdedrivare
Initialt är en kommersialisering aktuell i Norden till följd av erhållna godkännanden för Zeqmelit i de fyra stora nordiska länderna samt avtalet med Unimedic Pharma. Parallellt pågår även processer för att erhålla marknadsgodkännande på ytterligare marknader. En nära dialog med FDA förs för närvarande kring de uppgifter som Bolaget behöver komplettera med för att erhålla godkännande i USA. Avtalet med Unimedic Pharma agerar även som ett Proof of Concept för AcuCort, vilket väntas vara behjälpligt då det agerar som validering för produkten när ytterligare avtal med kommersialiseringspartners ska ingås.
7
Värdedrivare
1
Historisk lönsamhet
6
Ledning & Styrelse
7
Riskprofil
Samtliga analyser av bolag från och med år 2020 betygssätts utifrån ett nytt betygssystem - Värdedrivare, Historisk Lönsamhet och Ledning & Styrelse sträcker sig från 1 till 10, där 10 är högsta betyg. Riskprofil sträcker sig från 1 till 10, där 10 är att anse som högst risk. Aktieanalyser av bolag publicerade innan 2020 har betygssatts utifrån en annan modell.
Närmar sig bred marknadslansering
AcuCort AB (”AcuCort” eller ”Bolaget”) har erhållit godkännande inom samtliga nordiska länder för Bolagets användarvänliga kortisonfilm Zeqmelit samtidigt som siktet är inställt på godkännanden i andra utvalda marknader såsom USA, EU och Israel. Positiva resultat från enkät- och litteraturstudier har erhållits, vilket utgör underlag för ansökan om subvention hos Tandvårds- och Läkemedelsförmånsverket (TLV), där resultaten är av stor vikt för att nå ut till en bredare marknad. Analyst Group anser att AcuCort utvecklas väl rent operativt, trots detta är aktien lägre värderad än Peers som ligger efter AcuCort i kommersialiseringsfasen, varför Analyst Group ser en fortsatt god uppsida. Givet en diskonteringsränta om 13 % och ett riskjusterat Market Cap (nuvärde) om 138 MSEK, vidhåller vi ett potentiellt nuvärde per aktie om 4,4 (4,4) kr i ett Base scenario.
- Erhåller varumärkesskydd i Storbritannien
I maj 2023 erhöll AcuCort varumärkesskydd för Bolagets läkemedel Zeqmelit i Storbritannien av World Intellectual Property Organisation (WIPO). Med ytterligare ett varumärkesskyddat territorium säkrat ser Analyst Group att det stärker AcuCorts position inför kommande marknadslansering i Storbritannien, samt i diskussioner med potentiella partners. Registreringsskyddet löper enligt de datum som gäller för den internationella registreringen och måste förnyas senast den 9 januari 2033.
- Uppdatering kring dialog med FDA
AcuCort är för närvarande i dialog med amerikanska FDA där Bolaget i februari 2023 meddelade att FDA har begärt kompletterande uppgifter inför en registreringsansökan. I och med att AcuCort har flera marknadsgodkännanden på utvalda marknader delar vi Bolagets syn om att det inte skulle förändra ett positivt utfall av ansökan och är av uppfattningen att ett godkännande är sannolikt. AcuCort har i och med den förlängda handläggningstiden som kompletteringen innebär även fått datumet för sista inlämning under Small Business Waiver framskjutet. Därmed förlängs också tiden för befrielse från registreringsavgift om 1,6 MUSD, cirka 16,7 MSEK. Ett nytt sista datum för registreringsansökan under Small Business Waiver har ännu inte delgivits AcuCort, Bolaget kommer således meddela marknaden så fort kompletterande uppgifter godkänts av FDA och ett nytt sista registreringsdatum har kommunicerats av myndigheten.
- Värdedrivare
AcuCort står inför ett spännande år 2023, där värdedrivare som förväntas ligga i korten inkluderar ett potentiellt godkännande för pris- och subventionsansökan hos TLV, uppdateringar avseende partnerdialoger, samt från dialogen med FDA i USA. Med hänsyn till hur likartade bolag som befinner i övergången till kommersiell fas värderas, samt att AcuCort fortsätter ta viktiga steg mot en bredare marknadslansering, ser vi att det finns en fortsatt uppsida och god risk/reward i AcuCort.
7
Värdedrivare
1
Historisk lönsamhet
6
Ledning & Styrelse
8
Riskprofil
Samtliga analyser av bolag från och med år 2020 betygssätts utifrån ett nytt betygssystem - Värdedrivare, Historisk Lönsamhet och Ledning & Styrelse sträcker sig från 1 till 10, där 10 är högsta betyg. Riskprofil sträcker sig från 1 till 10, där 10 är att anse som högst risk. Aktieanalyser av bolag publicerade innan 2020 har betygssatts utifrån en annan modell.
Tar kliv i Norden mot kommersialisering i närtid
AcuCort AB (”AcuCort” eller ”Bolaget”) har erhållit godkännande inom samtliga nordiska länder för Bolagets användarvänliga kortisonfilm Zeqmelit samtidigt som siktet är inställt på godkännanden i andra utvalda marknader såsom USA, EU och Israel. Positiva resultat från enkät- och litteraturstudier har erhållits, vilket utgör underlag för ansökan om subvention hos Tandvårds- och Läkemedelsförmånsverket (TLV), där resultaten är av stor vikt för att nå ut till en bredare marknad. Analyst Group anser att AcuCort utvecklas väl rent operativt, trots detta är aktien lägre värderad än Peers som ligger efter AcuCort i kommersialiseringsfasen, varför Analyst Group ser en fortsatt god uppsida. Givet en diskonteringsränta om 13 % och ett riskjusterat Market Cap (nuvärde) om 138 MSEK, vidhåller vi ett potentiellt nuvärde per aktie om 4,4 (4,4) kr i ett Base scenario.
- AcuCort tecknar ett första kommersiellt avtal för Zeqmelit
AcuCort meddelade under Q4-22 att Bolaget har tecknat ett exklusivt kommersiellt avtal med det globala biofarmabolaget Kamada Ltd avseende den israeliska marknaden. Avtalet ger Kamada exklusiv rättighet till att marknadsföra, sälja, och distribuera AcuCorts läkemedel Zeqmelit för bland annat behandling av akut allergi på den israeliska marknaden. Israels befolkning uppgår per dags dato till ca 9 miljoner, med ett illustrativt exempel estimerar Analyst Group den totala bruttointäktspotentialen för Zeqmelit till ca 7,2 MUSD årligen på marknaden, givet ett antagande om att ca 20 % av befolkningen lider av allergi, en marknadspenetration om 10 %, och att läkemedlet förskrivs en gång per år med en genomsnittlig förbrukning om 4 doser, till ett genomsnittligt pris om 10 USD per dos.
- Flera värdedrivare i korten
AcuCort står inför ett spännande år 2023, där potentiella värdedrivare som förväntas ligga i korten inkluderar ett potentiellt godkännande för pris- och subventionsansökan hos TLV, uppdateringar avseende partnerdialoger, samt från registreringsansökan i USA.
- Mindre förändringar i värderingsintervallet
Givet att AcuCort för närvarande är i dialog med amerikanska FDA där Bolaget i februari 2023 meddelade att FDA har begärt kompletterande uppgifter inför en registreringsansökan, kan detta orsaka förseningar som påverkar kommande intäktsströmmar. Således justeras tidigare värderingsintervall ned i ett Bear scenario för att ta höjd för eventuella förseningar. Dock, med hänsyn till hur likartade bolag som befinner i övergången till kommersiell fas värderas, samt att AcuCort fortsätter ta viktiga steg mot en bredare marknadslansering, ser vi att det finns en fortsatt uppsida och god risk/reward i AcuCort avseende ett Base- och Bull scenario, där vi lämnar vår värdering oförändrad i båda dessa scenarion.
7
Värdedrivare
1
Historisk lönsamhet
6
Ledning & Styrelse
7
Riskprofil
Samtliga analyser av bolag från och med år 2020 betygssätts utifrån ett nytt betygssystem - Värdedrivare, Historisk Lönsamhet och Ledning & Styrelse sträcker sig från 1 till 10, där 10 är högsta betyg. Riskprofil sträcker sig från 1 till 10, där 10 är att anse som högst risk. Aktieanalyser av bolag publicerade innan 2020 har betygssatts utifrån en annan modell.
Nytt patentgodkännande medför stärkt marknadsposition
AcuCorts användarvänliga kortisonfilm Zeqmelit har erhållit godkännande inom flertalet nordiska länder, och siktet är nu inställt på godkännanden i övriga Norden och andra utvalda marknader såsom USA och EU. Positiva resultat från enkät- och litteraturstudier har erhållits, vilket kommer utgöra underlag för ansökan om subvention hos Tandvårds- och Läkemedelsförmånsverket (TLV), vidare ligger även en FDA-ansökan i korten under Q1-23. Analyst Group anser att AcuCort utvecklas väl rent operativt, med en god finansiell ställning, trots detta är aktien lägre värderad än peers som ligger efter AcuCort i kommersialiseringsfasen. Vi upprepar ett potentiellt värde om 4,4 kr per aktie i ett Base scenario, givet ett riskjusterat Market Cap (nuvärde) om 138 MSEK och en diskonteringsränta om 13 %.
- Godkännande i Norge och positiva enkätstudieresultat
AcuCort meddelade under tredje kvartalet att Bolaget erhållit godkännande från den norska läkemedelsmyndigheten för Zeqmelit, samt att Bolaget fått positiva resultat från enkätstudien gällande allergibehandling. Tidigare i år så har AcuCort även erhållit godkännande i Danmark. Sammantaget ser Analyst Group att AcuCort fortsätter att leverera på Bolagets regulatoriska strategi samtidigt som enkätstudien indikerar att det finns ett tydligt patientbehov för Zeqmelit.
- Stärkt position efter godkänt patent i Kanada
AcuCort meddelade efter utgången av tredje kvartalet att den kanadensiska patentmyndigheten (CIPO) beviljade ett patent för AcuCorts läkemedel Zeqmelit (tidigare ISICORT). Patentskyddet omfattar munfilmsteknologin med steroider vilket möjliggör en användarvänlig administrationsform för patienten. I och med detta patent stärker AcuCort sitt utgångsläge för att approchera den nordamerikanska marknaden, vilket Analyst Group ser som ett nödvändigt steg och en essentiell del i kommersialiseringsfasen.
- Finansiell position och burn rate
Vid utgången av Q3-22 uppgick kassan till ca 21,3 MSEK jämfört med 25,2 MSEK under föregående kvartal, och Bolagets burn rate per månad uppgick till ca -1,3 MSEK. Med nuvarande finansiell position och med antagande om en genomsnittlig burn rate per månad om -1,5 MSEK framgent, till följd av en disciplinerad kostnadskontroll, estimerar vi att AcuCort är finansierade fram tills H2-23, allt annat lika.
- Flera värdedrivare i korten
AcuCort står inför ett spännande nästa år, där potentiella värdedrivare som förväntas ligga i korten inkluderar nyheter gällande ansökan om subvention hos TLV, nya distributörs-avtal samt nyheter gällande marknadsgodkännanden och en potentiell ansökan till amerikanska läkemedelsmyndigheten FDA omkring Q1-23. Med hänsyn till hur likartade läkemedelsbolag som befinner sig i övergången till kommersiell fas värderas, ser vi att det finns en fortsatt uppsida och god risk/reward i AcuCort.
Godkännande i Danmark skapar regulatoriskt momentum
AcuCorts användarvänliga kortisonfilm ISICORT® har erhållit godkännande från Läkemedelsverket i Sverige och Danmark. Siktet är inställt på godkännanden i övriga Norden och andra prioriterade marknader som t.ex. USA och EU där AcuCort erhållit avgiftssänkningar. Besked om framsteg i enkät- och litteraturstudier väntar, vilket kommer utgöra underlag för ansökan om subvention hos TLV, och estimeras under H2-22. Beviljad subvention innebär att AcuCorts position stärks i de pågående diskussionerna med potentiella kommersiella partners. Rent operativt ser vi att AcuCort utvecklas fortsatt enligt plan där flera potentiella triggers kan utlösas under 2022 och framåt. Vi lämnar således värderingsintervallet oförändrat med 4,4 kr per aktie i ett Base scenario, givet ett riskjusterat Market Cap (nuvärde) om 138 MSEK och en diskonteringsränta om 13 %.
- Godkännandet i Danmark stärker AcuCorts position
AcuCort meddelade efter andra kvartalet att Bolaget erhållit marknadsgodkännande för ISICORT i Danmark under varumärkesnamnet Zeqmelit. Sedan tidigare har AcuCort marknadsgodkännande i Sverige, där Danmark blir nästa land i ledet. Registreringsprocessen fortgår i övriga norden samt EU, USA och andra prioriterade marknader där vi ser att ytterligare marknadsgodkännanden utgör värdedrivare som potentiellt kan leda till en upprevidering i våra prognoser.
- EMA beviljar AcuCort SME-status
Den europeiska läkemedelsmyndigheten (EMA) har beviljat AcuCort med Small- or Medium-sized Enterprise (SME) status vilket innebär bl.a. ekonomiska fördelar vid ansökning om marknadsgodkännande inom EU, t ex sänkta ansökningsavgifter. SME-statusen är tidsbegränsad och gäller till och med den 31 december 2023. SME-statusen kan jämföras med den så kallade Small Business Waiver som Bolaget erhöll för registreringsprocessen av ISICORT® i USA där en besparing om ca 15 MSEK medföljde. Analyst Group estimerar att besparingarna från EMA:s SME-status kan uppgå till ett minimum om 3 MSEK.
- Finansiell position och burn rate
Vid utgången av Q2-22 uppgick kassan till ca 25,2 MSEK jämfört med 29,9 MSEK under föregående kvartal, och Bolagets burn rate per månad uppgick till ca -1,6 MSEK. Med nuvarande finansiell position och med antagande om en genomsnittlig burn rate per månad om -1,5 MSEK framgent, vilket är i linje med genomsnittet på tolv månaders rullande basis, estimerar vi att AcuCort är finansierade tills H2-23, allt annat lika.
- Potentiella värdedrivare framöver
AcuCort står inför ett spännande år där potentiella värdedrivare som förväntas ligga i korten framöver inkluderar resultat från enkät- och litteraturstudier, nyheter gällande ansökan om subvention hos TLV, nya distributörsavtal samt nyheter gällande marknadsgodkännanden i prioriterade marknader. Bolaget fortsätter att utvecklas i rätt riktning där vi ser en attraktiv risk-reward från rådande bolagsvärde.
Läkemedelskandidat närmar sig nordiskt godkännande
AcuCorts användarvänliga kortisonfilm ISICORT® har tidigare erhållit godkännande från Läkemedelsverket i Sverige, och nu pågår även registreringsprocessen för den nordiska marknaden. Ytterligare besked om registreringsprocessen i Norden, vilket kan ske under H1-22, samt framsteg i ansökan om subvention hos TLV där besked estimeras under H2-22 innebär att AcuCorts position stärks i de pågående diskussionerna med potentiella kommersiella partners. Rent operativt ser vi att AcuCort utvecklas fortsatt enligt plan där flera potentiella triggers kan utlösas under 2022 och framåt. Vi lämnar således värderingsintervallet oförändrat. Detta innebär ett värderingsintervall om 2,0 – 6,6 kr med 4,4 kr i ett Base scenario.
- Ingen ansökningsavgift i USA meddelar FDA
FDA beviljade tidigare i år AcuCort befrielse från ansökningsavgiften för registreringsprocessen av ISICORT® i USA via en så kallad Small Business Waiver vilket innebär en besparing om motsvarande 15,4 MSEK, förutsatt att Bolaget lämnar in ansökan senast den 28:e februari 2023. Analyst Group ser detta som ett positivt besked då finansiering som skulle använts till mer omfattande regulatoriska processer istället kan användas vid ansökan på andra marknader och diverse marknadsinsatser, vilket kan öka sannolikheten för en lyckad kommersialisering framgent, givet att godkännande erhålls på respektive målmarknader.
- Första stegen mot läkemedelssubvention tagna
AcuCort lämnade nyligen in en ansökan om etikprövning avseende en enkätstudie med syfte att dokumentera hur allergipatienter värderar sin behandling. Enkätstudien estimeras omfatta ca 100 patienter som skall svara på frågor om sin allergi och om hur de värderar andra tillgängliga behandlingsalternativ. Enkätstudien är en viktig pusselbit då den kommer utgöra underlag för en framtida pris- och subventionsansökan till svenska Tandvårds- och Läkemedelsförmånsverket (TLV). Vi estimerar att AcuCort ansöker till TLV under H2-22, givet att etikprövningen godkänns.
- Finansiell position och burn rate
Vid utgången av Q1-22 uppgick kassan till ca 29,9 MSEK, och Bolagets burn rate uppgick till ca -2,0 MSEK per månad. Med nuvarande finansiell position och med antagande om en genomsnittlig burn rate om -1,5 MSEK per månad framgent estimerar vi fortsatt att AcuCort är finansierade tills slutet av 2023, allt annat lika.
- Potentiella värdedrivare framöver
Potentiella värdedrivare som kan ligga i korten framöver inkluderar godkännande av etikprövningen, ansökan om subvention hos TLV samt nyheter gällande registreringsprocessen i de nordiska målmarknaderna.
Kommersialisering i fortsatt fokus
ISICORT® har tidigare erhållit godkännande i Sverige och nu pågår även registreringsprocessen för den nordiska marknaden. Ett godkännande i Norden, vilket kan ske under H1-22, innebär att AcuCorts position stärks i de pågående diskussionerna med potentiella kommersiella partners. Rent operativt ser vi att AcuCort utvecklas fortsatt enligt plan. Emellertid har det ekonomiska klimatet under 2022 minst sagt varit kyligt för olönsamma utvecklingsbolag där riskpremierna stigit och investerare skiftat över till bolag med positiva kassaflöden. Vi ser tecken på att denna sektorrotation även påverkat AcuCort, där en ökad riskpremie får en direkt effekt i vår rNPV-modell. Detta innebär en justering av värderingsintervallet vilket nu sträcker sig mellan 2,0 – 6,6 kr med 4,4 (5,4) i ett Base scenario.
- Rapporten i linje med förväntningar
Vid utgången av Q4-21 uppgick kassan till ca 35,9 MSEK, och för de senaste tre rapporterade månaderna (Q4-21) har Bolagets burn rate uppgått till ca -1,3 MSEK per månad. Precis som vi har kommunicerat tidigare kvarhåller vi i våra modeller en förväntan om att AcuCort under kommande kvartal kommer att ha en något högre kapitalförbrukning. Det i sig är helt naturligt med tanke på kommande lansering av ISICORT.
- Nuvarande kassa och kapitalförburkning
Mellan Q3-21 och Q4-21 stärktes AcuCorts kassa med ca 26 MSEK via en företrädesemission samt riktad emission. I vår erfarenhet vet vi att en stärkt kassa för ett mindre läkemedelsbolag likt AcuCort är mycket fördelaktigt i samband med t.ex. att diskussioner förs med potentiella licenstagare. Det skapar nämligen ett bättre förhandlingsutrymme och gör att AcuCort kan agera mindre ”stressat” i förhandlingar, vilket i slutändan kan vara helt avgörande för att ett fördelaktigt avtal ska kunna komma på plats. Med en nuvarande kassa om 35,9 MSEK och en estimerad genomsnittlig burn rate om -1,5 MSEK per månad framgent, skulle det innebära att AcuCort är finansierade tills slutet av 2023, allt annat lika.
- Nytt avtal med kontraktstillverkaren Adhex Pharma
Under Q1-22 meddelade AcuCort att ett nytt avtal tecknats med kontraktstillverkaren Adhex Pharma avseende kommersiell produktion av ISICORT. Detta är en viktig milstolpe för AcuCort då det säkerställer produkt-försörjningen av ISICORT inför lanseringen och minskar således den operationella risken. Vi ser detta som ett robust samarbete med en lämplig partner då Adhex Pharma är specialister inom framställning av tunna munfilmer vilket passar ISICORTs produktprofil.
- Fortsatt attraktiv risk-reward
Med hänsyn till nuvarande börsvärde om ca 75 MSEK och Enterprise Value (EV) om 40 MSEK, samt potentiella värdedrivare framgent, ser vi en fortsatt attraktiv risk-reward i aktien.
Redo att ta nästa kliv
ISICORT® har tidigare erhållit godkännande i Sverige och nu pågår även registreringsprocessen för den nordiska marknaden. Ett godkännande i Norden, vilket kan ske under Q1-22, innebär att AcuCorts position stärks i de pågående diskussionerna med potentiella kommersiella partners. Det, i kombination med en stark finansiell position, är till AcuCorts fördel även vid pågående partnerdialoger på andra prioriterade marknader då det ger AcuCort ett ännu bättre förhandlingsläge. AcuCort tar fortsatt kliv framåt och i samband med Q3-rapporten, samt med hänsyn till den aktuella kapitalstrukturen efter genomförda emissioner, upprepar vi därför vårt värderingsintervall i termer av motiverat riskjusterat bolagsvärde i ett Base scenario. Med hänsyn till de nu 31.2M utestående aktierna, motsvarar det ett nuvärde om 5,4 kr per aktie.
- Rapporten i linje med förväntningar
Vid utgången av Q3-21 uppgick kassan till ca 14,4 MSEK, vilket kan jämföras med ca 17,6 MSEK vid utgången av juni (Q2-21). Under kvartalet uppgick därmed Bolagets burn rate, till -1,1 MSEK/månad, vilket är något lägre än under Q2-21. Precis som vi har kommunicerat tidigare har vi i våra modeller dock räknat med att AcuCort under kommande kvartal kommer att ha en något högre kapitalförbrukning. Det i sig är helt naturligt med tanke på den kommande kommersialiseringen av ISICORT.
- Påfylld kassa
Efter utgången av Q3-21 har AcuCort fyllt på sin kassa med ca 26 MSEK via en företrädesemission samt riktad emission. Med den utgående kassan per den sista september, samt kapitaltillskottet från emissionerna, har AcuCort en stark finansiell position. I vår erfarenhet vet vi att detta för ett mindre läkemedelsbolag likt AcuCort är mycket fördelaktigt i samband med t.ex. att diskussioner förs med potentiella licenstagare. Det skapar nämligen ett bättre förhandlingsutrymme och gör att AcuCort kan agera mindre ”stressat” i förhandlingar, vilket i slutändan kan vara helt avgörande för att ett fördelaktigt avtal ska kunna komma på plats. Med nuvarande finansiell position och ett antagande om en genomsnittlig burn rate om
-1,5 MSEK/månad, skulle det innebära att AcuCort är finansierade tills slutet av 2023.
- Kommersialisering i fortsatt fokus
Vad gäller den kommersiella resan skriver AcuCort att de har växlat upp takten i sina dialoger med potentiella partners i Europa, USA och på utvalda nyckelmarknader som har förmåga att lansera ISICORT på sina respektive lokala marknader. Information kring detta kan komma att utgöra bra värdedrivare i aktien under kommande kvartal.
- Fortsatt attraktiv risk-reward
Med hänsyn till nuvarande Market Cap om ca 87 MSEK och Enterprise Value (EV) om 47 MSEK, samt potentiella väderdrivnare framgent, ser vi en fortsatt attraktiv risk-reward i aktien.
Fortsatt undervärderad läkemedelsaktie
Det stora fokuset framgent är fortsatt hänförligt till arbetet med att lansera ISICORT® på marknaden, vilket inkluderar att allt ska komma på plats så effektivt som möjligt enligt den fastställda planen för att säkerställa en storskalig kommersiell produktion. AcuCort har siktet inställt på flera marknader och lägger nu bl.a. stor vikt vid att anpassa bolagets registreringsansökan för den amerikanska läkemedelsmarknaden i syfte att optimera ett framtida positivt utfall. Även Europa utgör en viktig marknad där AcuCort arbetar med en s.k. Mutual Recognition Process för att registrera ISICORT® på flera marknader inom Europa. I vår mening utvecklas AcuCort helt enligt plan, samtidigt som vi anser att detta inte återspeglas i nuvarande värdering av aktien. I samband med Q2-rapporten upprepar vi därför vårt värderingsintervall, där vi i ett Base scenario ser ett riskjusterat nuvärde om 8 kr (8) per aktie.
- Attraktiv risk-reward i aktien
Parallellt med marknadsarbetet kring ISICORT® pågår aktiva dialoger med olika potentiella licenstagare och samarbetspartners, där AcuCort fokuserar på välrenommerade, resursstarka partners med erfarenhet av allergimarknaden samt med en förmåga att lansera ISICORT® på sin lokala marknad. Eventuell kommunikation kring detta, vilket Analyst Group ser som tänkbart under kommande kvartal i år, kan komma att utgöra en stark värdedrivare i aktien. Med det i åtanke, och med hänsyn till nuvarande bolagsvärde om ca 85 MSEK i skrivande stund, ser vi en fortsatt attraktiv risk-reward i aktien.
- Ökat burn rate i linje med estimat
Vid utgången av Q2-21 uppgick kassan till ca 17,6 MSEK, vilket kan jämföras med ca 21,6 MSEK vid utgången av mars (Q1-21). Under Q2-21 uppgick därmed AcuCorts kapitalförbrukning, s.k. burn rate, till -1,3 MSEK/månad, vilket därmed är något högre än under föregående kvartal (-0,8 MSEK/mån). Precis som vi har kommunicerat tidigare till marknaden har vi i våra modeller räknat med att AcuCort under kommande kvartal kommer att ha en något högre kapitalförbrukning. Det i sig är helt naturligt med tanke på den kommande kommersialiseringen av ISICORT®. Med det sagt, och med tanke på den utgående kassan per den sista juni, anser vi fortsatt att AcuCort har en stark finansiell position. Bolaget har dessutom nyligen flyttat till mer kostnadseffektiva lokaler, vilket förväntas bidra positivt till kommande månaders kassaflöde.
- Upprepar uppsida i ett Base scenario
Vi ser fortsatt positivt på AcuCort som utvecklas i linje med våra förväntningar. Därmed, i samband med Q2-rapporten, väljer vi att behålla vårt tidigare värderingsintervall och upprepar vårt Base scenario där vi ser ett riskjuterat nuvärde per aktie om 8 kr.
Siktet inställt mot marknadslansering
AcuCort verkar göra alla rätt och allt pekar nu på att en lansering av ISICORT, där Sverige blir första marknad, är närstående. Mer än 20 % av jordens befolkning lider av allergi i någon form och andelen drabbade ökar snabbt, något som förväntas kunna bidra till en snabbare försäljningstillväxt av just ISICORT. Parallellt arbetar AcuCort vidare med de regulatoriska processerna i EU och USA. I vår mening utvecklas AcuCort helt enligt plan och med en fortsatt god kostnadskontroll har Bolaget en stark finansiell position. I samband med Q1-rapporten har vi valt att lämna vårt värderingsintervall oförändrat, där vi i ett Base scenario upprepar ett riskjusterat nuvärde om 8 kr (8) per aktie.
- Kostnadskontroll på toppnivå
Under Q1-21 uppgick AcuCorts totala rörelsekostnader till ca 2 MSEK (2,7), motsvarande en minskning om ~25 % mot jämförbart kvartal 2020 samtidigt som det var i linje med föregående kvartal (Q4-20). Vi anser att AcuCort tillhör den kategorin av läkemedelsbolag på de mindre börslistorna som uppvisar högst grad av kostnads-kontroll. Med tanke på det läget som Bolaget befinner sig i, med en närstående kommersialisering, är detta såklart något vi ser positivt på. Samtidigt, till följd av just kommersialiseringen, räknar vi med att AcuCorts totala kostnadsbas kommer att stiga framgent, vilket är naturligt under en sådan fas.
- Marknadslansering och licensavtal runt hörnet
Under H1-21 har AcuCorts team stärkts ytterligare med Louise Harting, som har tidigare erfarenhet från bl.a. Novo Nordisk där hon hade ansvar hänförligt till internationella produktlanseringar inom läkemedelsindustrin – erfarenheter som minst sagt passar väl in i rådande läge för AcuCort. Pusselbitarna för en framgångsrik introduktion av ISICORT på marknaden faller på plats en efter en, parallellt med att diskussioner fortsatt pågår med tänkbara licenstagare och samarbets-parters. Lansering och ett licensavtal bedömer vi skulle utgöra starka värdedrivare i aktien.
- Fortsatt stark finansiell position
AcuCort har under lång tid bevisat sin förmåga att utveckla verksamheten med god kostnadskontroll, något som även blev fallet under Q1-21. Under kommande kvartal räknar vi dock som sagt med att AcuCort kommer ha en något högre kapitalförbrukning, vilket är helt naturligt med tanke på den kommande lanseringen. Likväl, med senast rapporterad kassa om 22 MSEK, anser vi fortsatt att AcuCort har en stark finansiell position.
- Bibehåller vårt värderingsintervall
AcuCort utvecklas in linje med våra förväntningar, varför vi endast gjort mindre justeringar i vår finansiella modell. I samband med Q1-rapport väljer vi därför att lämna värderingsintervallet oförändrat i samtliga tre scenarion Base-, Bull- och Bear.
Kommersialisering och regulatoriskt arbete i fokus
Mer än 20 % av jordens befolkning lider av allergi i någon form och andelen drabbade ökar snabbt. Många drabbas även av svåra reaktioner i situationer där tillgång till t.ex. vatten är begränsad. ISICORT® tillgodoser ett tydligt behov och med ett marknadsgodkännande i Sverige sedan oktober fokuserar AcuCort nu på att kommersialisera produkten. Parallellt arbetar AcuCort vidare med de regulatoriska processerna i EU och USA. I vår mening utvecklas AcuCort helt enligt plan och med en fortsatt god kostnadskontroll har Bolaget en stark finansiell position. I samband med Q4-rapporten har vi valt att lämna vårt värderingsintervall oförändrat, där vi i ett Base scenario ser ett riskjusterat nuvärde om 8 kr per aktie.
- Godkännande för behandling av Covid-19
Under H1-20 uppmärksammades det att dexametason, vilket är den aktiva substansen i AcuCorts produkt ISICORT, kan reducera dödligheten bland personer som insjuknat i Covid-19. Sedan dess har Bolaget fortsatt att följa fördjupningsstudier i frågan, och under februari 2021 beviljade det svenska Läkemedelsverket ISICORT-indikationen för behandling av patienter med Covid-19 som behöver syrgasbehandling. Utöver att fylla en viktig funktion inom vården, kommer detta även väl till hands för AcuCort i samband med de kommande ansökningarna om marknadsgodkännande inom EU och USA.
- Värdedrivande aktiviteter under 2021
Val av försäljningspartner och distributörer, marknadsföringsstrategi, den nationella pris- och subventionsansökan, förberedelser för kommersiell produktion och logistik – alla dessa aktiviteter och tillhörande kommunikation från AcuCort utgör potentiella värdedrivare i aktien under kommande kvartal 2021. Parallellt med kommersialiseringsarbetet av ISICORT i Sverige arbetar AcuCort vidare med att erhålla godkännande inom EU genom den s.k. Mutual Recognition Procedure (MRP). Även arbetet med USA-registrering fortgår, där AcuCort i samråd med FDA har identifierat en regulatorisk strategi för marknadsgodkännande.
- Fortsatt stark finansiell position
AcuCort har under lång tid bevisat sin förmåga att utveckla verksamheten med god kostnadskontroll, något som även blev fallet under Q4-20. Under kommande kvartal räknar vi dock med att AcuCort kommer ha en något högre kapitalförbrukning, vilket är helt naturligt med tanke på den kommande kommersialiseringen. Likväl, med senast rapporterad kassa om 24 MSEK, anser vi fortsatt att AcuCort har en stark finansiell position.
- Bibehåller vårt värderingsintervall
AcuCort utvecklas in linje med våra förväntningar, varför vi endast gjort mindre justeringar i vår finansiella modell. I samband med Q4-rapport väljer vi därför att lämna värderingsintervallet oförändrat i samtliga tre scenarion Base-, Bull- och Bear.
Läkemedelsbolaget som går från klarhet till klarhet
ISICORT® erhöll under oktober marknadsgodkännande från svenska Läkemedelsverket, varpå förberedelser för kommersialiseringsfasen nu pågår för fullt. Parallellt avser AcuCort att ansöka om vidare godkännande inom EU, och har dessutom i samråd med FDA i USA identifierat en regulatorisk strategi för ett godkännande på den amerikanska marknaden. I vår bok går AcuCort från klarhet till klarhet, samtidigt som Bolagets likvida medel utgör en fortsatt trygghet i balansräkningen. Med hänsyn till godkännandet från Läkemedelsverket har vi i samband med Q3-rapporten valt att justera upp vårt värderings-intervall. Genom en rNPV-värdering ges ett riskjusterat potentiellt nuvärde om ca 157 MSEK, motsvarande 8 kr (6) per aktie, i ett Base scenario.
- Erhållit godkännande av Läkemedelsverket
Under oktober 2020 stod det klart att Läkemedelsverket i Sverige givit ISICORT marknadsgodkännande, ett besked som vi i vårt Base scenario räknande med skulle komma först mot slutet av Q4-20 men som nu levererades ett par veckor tidigare. Förberedande aktiviteter pågår nu för marknadslansering i Sverige, bl.a. sammanställning av en nationell pris- och subventionsansökan, förberedelser för kommersiell produktion och logistik samt implementering och godkännande av ett uppdaterat kvalitetssystem som möjliggör partihandelstillstånd. Vi kommer följa noga hur detta arbete fortlöper och vad som kan komma att kommuniceras från AcuCort, då nämnda faktorer styr när en aktiv försäljning av ISICORT kan påbörjas i Sverige.
- Pågående diskussioner med samarbetspartners
AcuCort har meddelat att det pågår fortlöpande dialoger med potentiella framtida partners som tillsammans med AcuCort kan ansvara för försäljning och marknadsföring av ISICORT på de lokala marknaderna. Ett eventuellt samarbete skulle kunna utgöra en potentiellt stark värdedrivare i aktien under kommande tolv månader.
- Fortsätter bearbeta EU och USA
AcuCort avser att ansöka vidare om godkännande inom EU genom den s.k. Mutual Recognition Procedure (MRP). AcuCort har även i samråd med FDA identifierat en regulatorisk strategi för ett godkännande i USA. Regulatoriska framgångar inom EU och USA kan ses som ytterligare tänkbara ”triggers” i aktien.
- Höjer vårt värderingsintervall
ISICORT har fått godkänt av Läkemedelsverket och står nu närmare marknaden än någonsin förr, samtidigt som AcuCort för tillfället värderas till omkring 118 MSEK (Market Cap). Med tanke på ISICORT:s produktegenskaper, närheten till marknaden och AcuCorts finansiella ställning idag, kan det argumenteras för att det borde finnas utrymme för högre värderingsnivåer i aktien. I samband med Q3-rapport har vi därför valt att höja vårt värderingsintervall i samtliga tre scenarion Base-, Bull- och Bear.
Marknadsgodkännande kan ligga runt hörnet
AcuCorts produkt ISICORT® skulle kunna närma sig marknadsgodkännande i Sverige mot slutet av 2020 och försäljningen estimeras då påbörjas under 2021. ISICORT har väsentliga patientfördelar vilket ger goda förutsättningar, vid läkemedelsgodkännande, för en omfattande framtida tillväxt. Bolagets adresserbara marknad bedöms uppgå till 3,4 mdUSD, och nuvarande ledning och styrelse anses inneha rätt kompetenser för att utveckla Bolaget i en positiv riktning. Genom en rNPV-värdering ges ett riskjusterat potentiellt nuvärde om ca 115 MSEK, motsvarande 6 kr per aktie, i ett Base scenario.
- Fortsätter ta steg mot markandslansering
Under Q2-20 har AcuCort fortsatt lagt ett stort fokus kring att ta fram bra underlag till Läkemedelsverket för ansökan om ett nationellt marknadsgodkännande av ISICORT, där AcuCort enligt plan den 11 augusti 2020 lämnande in svarsdossiern avseende den andra utvärderingsrapporten. AcuCort fortsätter ta steg i rätt riktning och i dagsläget ser Analyst Group det som fortsatt möjligt att ISICORT skulle kunna närma sig ett marknadsgodkännande i Sverige mot slutet av det här året.
- Ny VD rekryterad
Jonas Jönmark tillträdde under augusti som ny VD, han har en MBA-examen från Lunds universitet och över 20 års erfarenhet från ledande befattningar och VD-roller inom läkemedelsindustrin och life science-sektorn. Hans karriär har inkluderat stora internationella läkemedelsföretag, bl.a. Pfizer, Astellas Pharma och Astra Zeneca, samt även mindre startupbolag som Life Science Support och Alteco Medical. Med tanke på Jonas tidigare erfarenheter av internationella produktlanseringar, etablering av sälj- och distributionskanaler, kommersiella partnerskap, prissättnings- och ersättningsförhandlingar med myndigheter samt internationell affärsutveckling, anser vi att rekryteringen är en värdefull beståndsdel i den utvecklingen som ska ta AcuCort till nya nivåer.
- Stabil kassa minskar den finansiella risken
Under H1-20 uppgick AcuCorts operativa kapitalförbrukning, s.k. burn rate, till ca -0,8 MSEK/månad, vilket vi anser är lågt och således något vi ser positivt på. En viktig faktor att ta i beaktande är hur länge nuvarande likviditet räcker till. Med avstamp i den utgående kassan per juni månad, historisk burn rate och en uppskattning kring framtida kapitalbehov, räknar vi med att AcuCort är finansierade en bra bit in i 2021.
- Lämnar vårt värderingsintervall oförändrat
ISICORT står nära marknaden och för tillfället värderas AcuCort till omkring 100 MSEK (Market Cap). Med tanke på ISICORT:s produktegenskaper, närheten till marknaden och AcuCorts finansiella ställning idag, kan det argumenteras för att det borde finnas utrymme för högre värderingsnivåer i aktien.
Fortsätter att ta steg i rätt riktning
AcuCorts produkt ISICORT® skulle kunna närma sig marknadsgodkännande i Sverige mot slutet av 2020 och försäljningen estimeras då påbörjas under 2021. ISICORT har väsentliga patientfördelar vilket ger goda förutsättningar, vid läkemedelsgodkännande, för en omfattande framtida tillväxt. Bolagets adresserbara marknad bedöms uppgå till 3,4 mdUSD, och ledning och styrelse anses inneha rätt kompetenser för att utveckla Bolaget i en positiv riktning. Genom en rNPV-värdering ges ett riskjusterat potentiellt nuvärde om ca 115 MSEK, motsvarande 6 kr per aktie, i ett Base scenario.
- Fokus på svarsrapporten till Läkemedelsverket
Under februari erhöll AcuCort den första utvärderingsrapporten från Läkemedelsverket av den nationella ansökan om marknadsgodkännande för ISICORT. Rapporten omfattar både en klinisk del och en kvalitetsdel, med en huvudpart av praktiska frågor rörande kvalitet och tillverkning. Senaste veckorna har AcuCort lagt ett stort fokus på att ta fram en svarslista med goda underlag, där målbilden är att AcuCort ska lämna in sin rapport till Läkemedelsverket den 8 maj. I dagsläget ser Analyst Group det som fortsatt möjligt att ISICORT skulle kunna närma sig ett marknadsgodkännande i Sverige mot slutet av det här året.
- Endast begränsade effekter från Covid-19
I Q1-rapporten skriver AcuCort om hur effekterna av pandemi-utbrottet kan påverka Bolagets situation och/eller utveckling, där bedömningen för närvarande är att påverkan endast är begränsad. I nuläget är AcuCorts samarbete med sin tillverkningspartner och regulatoriska experter av stor vikt, vilka skall ha säkrat en fortlöpande verksamhet med bibehållen kvalitetsnivå.
- Fortsatt goda möjligheter för USA-registrering
AcuCort meddelade i början av året en positiv syn på att utfallet i den andra bioekvivalensstudien för USA inte är ett hinder för att ansöka om marknadsgodkännande av ISICORT på USA-marknaden. Den tidigare tillsatta expertgruppen presenterade bl.a. handlingsalternativ för att möjliggöra registrering och kommersialisering av ISICORT på den amerikanska marknaden. Vad som är extra betryggande är att dessa slutsatser har bekräftats av ytterligare två oberoende expertinstanser i USA och Tyskland.
- Risker kring kapitalbehov och samarbetsavtal
AcuCort genomförde under hösten 2019 en nyemission om ca 41 MSEK, vilken förväntas kunna täcka kapital-behovet en bra bit in i 2021. Däremot kan framtida nyemissioner inte uteslutas, vilket i sig får anses utgöra en riskfaktor. Vidare får även avsaknad av samarbetspartners ses som en potentiell risk. Detta är dock något som AcuCort arbetar intensivt med, där det har kommunicerats att samtal pågår.
Fortsätter att närma sig marknadslansering
AcuCorts produkt ISICORT® skulle kunna närma sig marknadsgodkännande i Sverige mot slutet av 2020 och försäljningen estimeras påbörjas under 2021. ISICORT har väsentliga patientfördelar vilket ger goda förutsättningar, vid läkemedelsgodkännande, för en omfattande framtida tillväxt. Bolagets adresserbara marknad bedöms uppgå till 3,4 mdUSD, och ledning och styrelse anses inneha rätt kompetenser för att utveckla Bolaget i en positiv riktning. Genom en rNPV-värdering ges ett riskjusterat potentiellt nuvärde om ca 115 MSEK, motsvarande 6 kr per aktie, i ett Base scenario.
- Fortsatt goda möjligheter för USA-registrering
AcuCort meddelade tidigare i år en positiv syn på att utfallet i den andra bioekvivalensstudien för USA inte är ett hinder för att ansöka om marknadsgodkännande av ISICORT på USA-marknaden. Nyheten var minst sagt välkommen där den tidigare tillsatta expertgruppen bl.a. presenterade handlingsalternativ för att möjliggöra registrering och kommersialisering av ISICORT på den amerikanska marknaden. Det känns även extra betryggande att dessa slutsatser har bekräftats av ytterligare två oberoende expertinstanser i USA och Tyskland.
- Har fått svar från Läkemedelsverket
Under september 2019 lämnade AcuCort in en nationell hybridansökan för marknadsgodkännande av ISICORT till svenska Läkemedelsverket. Under februari 2020 meddelade AcuCort att myndigheten återkommit med den första utvärderingsrapporten, där det bl.a. framgick att ”[…] Det gavs inga formella starka invändningar och den initiala analysen av rapporten och frågelistan tyder inte på några stora stötestenar.” Utfallet är såklart något vi anser är minst sagt positivt.
- Vi behåller vår positiva syn på bolaget
ISICORT är en produkt som verkligen kan hjälpa patienter till en bättre livskvalitet, inom flera olika områden. Produkten står nära marknaden och för tillfället värderas AcuCort till omkring 60 MSEK (Market Cap). Med tanke på ISICORT:s produktegenskaper, närheten till marknaden och AcuCorts finansiella ställning idag, kan det argumenteras för att det borde finnas utrymme för högre värderingsnivåer i aktien.
- Risker kring kapitalbehov och samarbetsavtal
AcuCort har under hösten 2019 genomfört en nyemission om ca 41 MSEK, vilket förväntas kunna täcka kapitalbehovet en bra bit in i 2021. Däremot kan framtida nyemissioner inte uteslutas, vilket i sig får anses utgöra en riskfaktor. Vidare får även avsaknande av samarbetspartners ses som en potentiell risk. Detta är dock något som AcuCort arbetar intensivt med, där det har kommunicerats att samtal pågår.
Kommersialisering inom räckhåll efter fortsatta steg mot godkännande
AcuCorts produkt ISICORT®, som innan namnbyte hette Dexa ODF, väntas nå marknadsgodkännande i Sverige under 2020 och försäljningen estimeras påbörjas tidigt 2021. ISICORT har väsentliga patientfördelar vilket ger goda förutsättningar, vid läkemedelsgodkännande, för en omfattande framtida tillväxt. Bolagets adresserbara marknad bedöms uppgå till 3,4 mdUSD, och ledning och styrelse anses inneha rätt kompetenser för att utveckla Bolaget i en positiv riktning. Genom en rNPV-värdering ges ett riskjusterat potentiellt nuvärde om 102 MSEK, motsvarande 5,2 SEK per aktie, i ett Base scenario.
- Patientfördelar med produkten talar för framtida tillväxt
AcuCorts produkt, ISICORT är en film som läggs på tungan, som sedan löses upp via munnens saliv. Produkten erbjuder flera fördelar jämfört med dagens alternativ. En film är stark nog för att räcka per allergisk reaktion. Det krävs inget vatten, vilket är av vikt då en akut allergisk reaktion ofta sker vid ett tillfälle då tillgång till just vatten saknas. ISICORTs förpackning är är ungefär lika stor som ett visitkort, vilket gör att det alltid är lättillgängligt.
- Kompetent och erfaren ledning och styrelse
AcuCorts VD och styrelse besitter en bred kompetens och erfarenhet från läkemedelsbranschen. Bolagets huvudägare, AQILION AB (tidigare P.U.L.S. AB), är ett bolag vars affärsmodell är att investera i life science-projekt för att sedan utveckla dessa. Bolagets styrelse består av både medicinkunniga och marknadskunniga människor som har kompetenser och erfarenheter från läkemedelsutveckling samt regulatoriska frågor inom ansökningsprocesser gällande läkemedelsansökningar. Vidare har även VD Mats Lindfors en lång erfarenhet inom branschen från tidigare uppdrag med ledande befattningar inom försäljning och marknadsföring från bl.a. HemoCue AB.
- Tydlig väg mot kommersialisering
Under 2019 har AcuCort skickat in ansökan till Läkemedelsverket och det innebär att ISICORT kan bli godkänt i Sverige under 2020. Givet ett godkännande kan Bolaget sedan gå vidare genom en så kallad Mutual Recognition Process för att få godkännande i fler EU-länder. Osäkerhet har uppstått kring registreringen av ISICORT i USA på grund av att bioekvivalens inte kunde visas i den andra av två studier. Den första studien har visat bioekvivalens. Givet godkänt läkemedel krävs det att AcuCort sluter avtal med samarbetspartners, för distribution och/eller licensiering, för att kommersialiseringen ska lyckas.
- Risk relaterad till kapitalbehov och samarbetsavtal
Bolaget har genomfört en nyemission om 42,1 MSEK, vilket förväntas täcka kapitalbehovet en bit in i 2021, däremot kan framtida nyemissioner inte uteslutas. Vidare får även avsaknaden av samarbetspartners ses som en risk. Detta är något som Bolaget dock jobbar intensivt med, där de har kommunicerat att samtal pågår.
Kommersialisering närmare efter fortsatta steg mot godkännande
AcuCorts produkt ISICORT®, som innan namnbyte hette Dexa ODF, väntas nå marknadsgodkännande under 2020 och försäljningen estimeras påbörjas tidigt 2021. ISICORT har väsentliga patientfördelar vilket ger goda förutsättningar, vid läkemedelsgodkännande, för en omfattande framtida tillväxt. Bolagets adresserbara marknad bedöms uppgå till 3,4 mdUSD, och ledning och styrelse anses inneha rätt kompetenser för att utveckla Bolaget i en positiv riktning. Genom en rNPV-värdering ges ett riskjusterat potentiellt nuvärde om 199 MSEK, motsvarande 10,1 SEK per aktie, i ett Base scenario.
- Patientfördelar med produkten talar för framtida tillväxt
AcuCorts produkt, ISICORT är en film som läggs på tungan, som sedan löses upp via munnens saliv. Produkten erbjuder flera fördelar jämfört med dagens alternativ. En film är stark nog för att räcka per allergisk reaktion. Det krävs inget vatten, vilket är av vikt då en akut allergisk reaktion ofta sker vid ett tillfälle då tillgång till just vatten saknas. ISICORTs förpackning är är ungefär lika stor som ett visitkort, vilket gör att det alltid är lättillgängligt.
- Kompetent och erfaren ledning och styrelse
AcuCorts VD och styrelse besitter en bred kompetens och erfarenhet från läkemedelsbranschen. Bolagets huvudägare, AQILION AB (tidigare P.U.L.S. AB), är ett bolag vars affärsmodell är att investera i life science-projekt för att sedan utveckla dessa. Bolagets styrelse består av både medicinkunniga och marknadskunniga människor som har kompetenser och erfarenheter från läkemedelsutveckling samt regulatoriska frågor inom ansökningsprocesser gällande läkemedelsansökningar. Vidare har även VD Mats Lindfors en lång erfarenhet inom branschen från tidigare uppdrag med ledande befattningar inom försäljning och marknadsföring från bl.a. HemoCue AB.
- Tydlig väg mot kommersialisering
Under 2019 har AcuCort fortsatt tagit viktiga steg mot att få läkemedelsgodkännande i EU och USA. Ansökan väntas skickas in till EU under hösten 2019, vilket kan innebära godkännande under 2020. Även processen i USA fortsätter enligt plan, då godkännande för den andra av två bioekvivalensstudier nyligen fick klartecken att påbörjas. Givet godkänt läkemedel krävs det att AcuCort sluter avtal med samarbetspartners, för distribution och/eller licensiering, för att kommersialiseringen ska lyckas. Bolaget för idag diskussioner med potentiella samarbetspartners men statusen för dessa är okänt.
- Risk relaterad till kapitalbehov och samarbetsavtal
Bolaget genomför en nyemission om 42,1 MSEK, vilket förväntas täcka kapitalbehovet en bit in i 2021, däremot kan framtida nyemissioner inte uteslutas. Vidare får även avsaknaden av samarbetspartners ses som en risk. Detta är något som Bolaget dock jobbar intensivt med, där de har kommunicerat att samtal pågår.
Kommersialisering närmare efter fortsatta steg mot godkännande
AcuCorts produkt ISICORT®, som innan namnbyte hette Dexa ODF, väntas nå marknadsgodkännande under 2020 och försäljningen estimeras påbörjas i slutet av 2020. ISICORT har väsentliga patientfördelar vilket ger goda förutsättningar, vid läkemedelsgodkännande, för en omfattande framtida tillväxt. Bolagets adresserbara marknad bedöms uppgå till 3,4 mdUSD, och ledning och styrelse anses inneha rätt kompetenser för att utveckla Bolaget i en positiv riktning. Genom en rNPV-värdering ges ett riskjusterat potentiellt nuvärde om 199 MSEK, motsvarande 16,0 SEK per aktie, i ett Base scenario.
- Patientfördelar med produkten talar för framtida tillväxt
AcuCorts produkt, ISICORT är en film som läggs på tungan, som sedan löses upp via munnens saliv. Produkten erbjuder flera fördelar jämfört med dagens alternativ. En film är stark nog för att räcka per allergisk reaktion. Det krävs inget vatten, vilket är av vikt då en akut allergisk reaktion ofta sker vid ett tillfälle då tillgång till just vatten saknas. ISICORTs förpackning är är ungefär lika stor som ett visitkort, vilket gör att det alltid är lättillgängligt.
- Kompetent och erfaren ledning och styrelse
AcuCorts VD och styrelse besitter en bred kompetens och erfarenhet från läkemedelsbranschen. Bolagets huvudägare, AQILION AB (tidigare P.U.L.S. AB), är ett bolag vars affärsmodell är att investera i life science-projekt för att sedan utveckla dessa. Bolagets styrelse består av både medicinkunniga och marknadskunniga människor som har kompetenser och erfarenheter från läkemedelsutveckling samt regulatoriska frågor inom ansökningsprocesser gällande läkemedelsansökningar. Vidare har även VD Mats Lindfors en lång erfarenhet inom branschen från tidigare uppdrag med ledande befattningar inom försäljning och marknadsföring från bl.a. HemoCue AB.
- Tydlig väg mot kommersialisering
Under 2019 har AcuCort fortsatt tagit viktiga steg mot att få läkemedelsgodkännande i EU och USA. Ansökan väntas skickas in till EU under hösten 2019, vilket kan innebära godkännande under 2020. Även processen i USA fortsätter enligt plan, då godkännande för den andra av två bioekvivalensstudier nyligen fick klartecken att påbörjas. Givet godkänt läkemedel krävs det att AcuCort sluter avtal med samarbetspartners, för distribution och/eller licensiering, för att kommersialiseringen ska lyckas. Bolaget för idag diskussioner med potentiella samarbetspartners men statusen för dessa är okänt.
- Risk relaterad till kapitalbehov och samarbetsavtal
Bolaget har kommunicerat att en ny kapitalanskaffning kommer krävas under 2019, vilken väntas under H2-19. Villkoren är dock i dagsläget okända. Vidare får även avsaknaden av klara samarbetspartners ses som en risk. Detta är något som Bolaget dock jobbar intensivt med, där de har kommunicerat att samtal pågår.
Flertalet potentiella triggers under resterande delen av 2019
AcuCorts produkt Dexa ODF väntas nå marknadsgodkännande under 2020 och försäljningen estimeras påbörjas i slutet av 2020. Dexa ODF har väsentliga patientfördelar vilket ger goda förutsättningar, vid läkemedelsgodkännande, för en omfattande framtida tillväxt. Bolagets adresserbara marknad bedöms uppgå till 3,4 mdUSD, och ledning och styrelse anses inneha rätt kompetenser för att utveckla Bolaget i en positiv riktning. Genom en rNPV-värdering ges ett riskjusterat potentiellt nuvärde om 199 MSEK, motsvarande 16,0 SEK per aktie, i ett Base scenario.
- Patientfördelar med produkten talar för framtida tillväxt
AcuCorts produkt, Dexa ODF, är en film som läggs på tungan, som sedan löses upp via munnens saliv. Produkten erbjuder flertalet fördelar för patienten jämfört med dagens alternativ. En film är tillräckligt stark för att räcka per allergisk reaktion. Det krävs inget vatten, vilket är av vikt då en akut allergisk reaktion ofta sker vid ett tillfälle då tillgång till just vatten saknas. Dexa ODF förpackas även i en liten försluten förpackning som är ungefär lika stor som ett visitkort, vilket gör att det går att ha med sig produkten i t.ex. plånboken, och alltid kan vara tillgänglig när allergireaktionen inträffar. Patientfördelarna bedöms attraktiva och bidra till ökad försäljning givet en lyckad marknadslansering.
- Kompetent och erfaren ledning och styrelse
AcuCorts VD och styrelse besitter en bred kompetens och erfarenhet från läkemedelsbranschen. Bolagets huvud-ägare, AQILION AB (tidigare P.U.L.S. AB), är ett bolag vars affärsmodell är att investera i life science-projekt för att sedan utveckla dessa. Bolagets styrelse består av både medicinkunniga och marknadskunniga människor som har kompetenser och erfarenheter från läkemedelsutveckling samt regulatoriska frågor inom ansökningsprocesser gällande läkemedelsansökningar. Vidare har även VD Mats Lindfors en lång erfarenhet inom branschen från tidigare uppdrag med ledande befattningar inom försäljning och marknadsföring från bl.a. HemoCue AB.
- I ett Base scenario värderas AcuCort till ett riskjusterat nuvärde om 16,0 kr per aktie
Bolagets ambition är att använda sig av ett globalt nätverk av samarbetspartners, där samarbeten antingen är distributions- eller licensbaserade. Givet att Bolaget når marknaden estimeras AcuCorts kassaflöden från Dexa ODF till ett riskjusterat nuvärde om 16,0 kr per aktie.
- Risk relaterad till kapitalbehov och samarbetsavtal
Bolaget har kommunicerat att en ny kapitalanskaffning kommer krävas under 2019, som väntas under H2-19 vilket innebär en okänt stor utspädning. Vidare får även avsaknaden av klara samarbetspartners ses som en risk. Detta är något som Bolaget dock jobbar intensivt med, där de har kommunicerat att samtal pågår.
Kommer allt närmare en kommersialisering av allergiläkemedel
AcuCorts produkt Dexa ODF väntas nå marknadsgodkännande under 2020 och försäljningen estimeras påbörjas i slutet av 2020. Dexa ODF har väsentliga patientfördelar vilket ger goda förutsättningar, vid läkemedelsgodkännande, för en omfattande framtida tillväxt. Bolagets adresserbara marknad bedöms uppgå till 3,4 mdUSD, och ledning och styrelse anses inneha rätt kompetenser för att utveckla Bolaget i en positiv riktning. Genom en rNPV-värdering ges ett riskjusterat potentiellt nuvärde om 195 MSEK, motsvarande 15,7 SEK per aktie, i ett Base scenario.
- Patientfördelar med produkten talar för framtida tillväxt
AcuCorts produkt, Dexa ODF, är en film som läggs på tungan, som sedan löses upp via munnens saliv. Produkten erbjuder flertalet fördelar för patienten jämfört med dagens alternativ. En film är tillräckligt stark för att räcka per allergisk reaktion. Det krävs inget vatten, vilket är av vikt då en akut allergisk reaktion ofta sker vid ett tillfälle då tillgång till just vatten saknas. Dexa ODF förpackas även i en liten försluten förpackning som är ungefär lika stor som ett visitkort, vilket gör att det går att ha med sig produkten i t.ex. plånboken, och alltid kan vara tillgänglig när allergireaktionen inträffar. Patientfördelarna bedöms attraktiva och bidra till ökad försäljning givet en lyckad marknadslansering.
- Kompetent och erfaren ledning och styrelse
AcuCorts VD och styrelse besitter en bred kompetens och erfarenhet från läkemedelsbranschen. Bolagets huvudägare, AQILION AB (tidigare P.U.L.S. AB), är ett bolag vars affärsmodell är att investera i life science-projekt för att sedan utveckla dessa. Bolagets styrelse består av både medicinkunniga och marknadskunniga människor som har kompetenser och erfarenheter från läkemedelsutveckling samt regulatoriska frågor inom ansökningsprocesser gällande läkemedelsansökningar. Vidare har även VD Mats Lindfors en lång erfarenhet inom branschen från tidigare uppdrag med ledande befattningar inom försäljning och marknadsföring från bl.a. HemoCue AB.
- I ett Base scenario värderas AcuCort till ett riskjusterat nuvärde om 15,7 kr per aktie
Bolagets ambition är att använda sig av ett globalt nätverk av samarbetspartners, där samarbeten antingen är distributions- eller licensbaserade. Givet att Bolaget når marknaden estimeras AcuCorts kassaflöden från Dexa ODF till ett riskjusterat nuvärde om 15,7 kr per aktie.
- Risk relaterad till kapitalbehov och samarbetsavtal
Bolaget har kommunicerat att en ny kapitalanskaffning kommer krävas under 2019, som väntas under H2-19 vilket innebär en okänt stor utspädning. Vidare får även avsaknaden av klara samarbetspartners ses som en risk. Detta är något som Bolaget dock jobbar intensivt med, där de har kommunicerat att samtal pågår.
AcuCorts produkt Dexa ODF väntas nå marknadsgodkännande mot slutet av 2019 och försäljningen påbörjas då under mitten av 2020. Dexa ODF har väsentliga patientfördelar vilket ger goda förutsättningar, vid läkemedelsgodkännande, för en omfattande framtida tillväxt. Bolagets adresserbara marknad bedöms uppgå till 3,4 mdUSD, och ledning och styrelse anses inneha rätt kompetenser för att utveckla Bolaget i en positiv riktning. Genom en rNPV-värdering ges ett riskjusterat potentiellt nuvärde om 135 MSEK, motsvarande 10,9 SEK per aktie, i ett Base scenario.
- Patientfördelar med produkten talar för framtida tillväxt
AcuCorts produkt, Dexa ODF, är en film som läggs på tungan, som sedan löses upp via munnens saliv. Produkten erbjuder flertalet fördelar för patienten jämfört med dagens alternativ. En film är tillräckligt stark för att räcka per allergisk reaktion. Det krävs inget vatten, vilket är av vikt då en akut allergisk reaktion ofta sker vid ett tillfälle då tillgång till just vatten saknas. Dexa ODF förpackas även i en liten försluten förpackning som är ungefär lika stor som ett visitkort, vilket gör att det går att ha med sig produkten i t.ex. plånboken, och alltid kan vara tillgänglig när allergireaktionen inträffar. Patientfördelarna bedöms attraktiva och bidra till ökad försäljning givet en lyckad marknadslansering.
- Kompetent och erfaren ledning och styrelse
AcuCorts VD och styrelse besitter en bred kompetens och erfarenhet från läkemedelsbranschen. Bolagets huvudägare, P.U.L.S. AB, är ett bolag vars affärsmodell är att investera i life science-projekt för att sedan utveckla dessa. Bolagets styrelse består av både medicinkunniga och marknadskunniga människor som har kompetenser och erfarenheter från läkemedelsutveckling samt regulatoriska frågor inom ansökningsprocesser gällande läkemedelsansökningar. Vidare har även VD Mats Lindfors en lång erfarenhet inom branschen från tidigare uppdrag, där han har haft ledande befattningar inom försäljning och marknadsföring från bl.a. HemoCue AB.
- I ett Base scenario värderas AcuCort till ett riskjusterat nuvärde om 10,9 kr per aktie
Bolagets ambition är att använda sig av ett globalt nätverk av samarbetspartners, där samarbeten antingen är distributions- eller licensbaserade. Givet att Bolaget når marknaden estimeras AcuCorts kassaflöden från Dexa ODF till ett riskjusterat nuvärde om 10,9 kr per aktie.
- Risk relaterad till kapitalbehov
Då Bolaget nyligen tog in 10,8 MSEK (efter emissions-kostnader) via en företrädesemission är den finansiella risken på kort sikt låg. Däremot bedöms den nuvarande kassan inte räcka för att nå break even, varför Bolaget förväntas behöva genomföra ytterligare en kapitalanskaffning under H2-2019.
AcuCorts produkt Dexa ODF väntas nå marknadsgodkännande mot slutet av 2019 och försäljningen påbörjas då under mitten av 2020. Dexa ODF har väsentliga patientfördelar vilket ger goda förutsättningar, vid läkemedelsgodkännande, för en omfattande framtida tillväxt. Bolagets adresserbara marknad bedöms uppgå till 3,4 mdUSD, och ledning och styrelse anses inneha rätt kompetenser för att utveckla Bolaget i en positiv riktning. Genom en rNPV-värdering ges ett riskjusterat potentiellt nuvärde om 123 MSEK, motsvarande 9,8 SEK per aktie, i ett Base scenario.
- Patientfördelar med produkten talar för framtida tillväxt
AcuCorts produkt, Dexa ODF, är en film som läggs på tungan, som sedan löses upp via munnens saliv. Produkten erbjuder flertalet fördelar för patienten jämfört med dagens alternativ. En film är tillräckligt stark för att räcka per allergisk reaktion. Det krävs inget vatten, vilket är av vikt då en akut allergisk reaktion ofta sker vid ett tillfälle då tillgång till just vatten saknas. Dexa ODF förpackas även i en liten försluten förpackning som är ungefär lika stor som ett visitkort, vilket gör att det går att ha med sig produkten i t.ex. plånboken, och alltid kan vara tillgänglig när allergireaktionen inträffar. Patientfördelarna bedöms attraktiva och bidra till ökad försäljning givet en lyckad marknadslansering.
- Kompetent och erfaren ledning och styrelse
AcuCorts VD och styrelse besitter en bred kompetens och erfarenhet från läkemedelsbranschen. Bolagets huvudägare, P.U.L.S. AB, är ett bolag vars affärsmodell är att investera i life science-projekt för att sedan utveckla dessa. Bolagets styrelse består av både medicinkunniga och marknadskunniga människor som har kompetenser och erfarenheter från läkemedelsutveckling samt regulatoriska frågor inom ansökningsprocesser gällande läkemedelsansökningar. Vidare har även VD Mats Lindfors en lång erfarenhet inom branschen från tidigare uppdrag, där han har haft ledande befattningar inom försäljning och marknadsföring från bl.a. HemoCue AB.
- I ett Base scenario värderas AcuCort till ett riskjusterat nuvärde om 9,8 kr per aktie
Bolagets ambition är att använda sig av ett globalt nätverk av samarbetspartners, där samarbeten antingen är distributions- eller licensbaserade. Givet att Bolaget når marknaden estimeras AcuCorts kassaflöden från Dexa ODF till ett riskjusterat nuvärde om 9,8 kr per aktie.
- Risk relaterad till kapitalbehov
Då Bolaget nyligen tog in 10,8 MSEK (efter emissionskostnader) via en företrädesemission är den finansiella risken på kort sikt låg. Däremot bedöms den nuvarande kassan inte räcka för att nå break even, varför Bolaget förväntas behöva genomföra ytterligare en kapitalanskaffning under H2-2019.
Analytikerkommentarer
Kommentar på AcuCorts avsiktsförklaring (LOI) med Glenmark Pharmaceuticals avseende Tyskland, Nederländerna, Tjeckien, Österrike, Slovakien och Ukraina
2025-06-17
Den 17 juni 2025 meddelade AcuCort (”AcuCort” eller ”Bolaget”) att Bolaget har ingått en avsiktsförklaring (LOI) med det globala läkemedelsbolaget Glenmark Pharmaceuticals (”Glenmark”), avseende distribution och marknadsföring av läkemedlet Zeqmelit® i sex europeiska länder: Tyskland, Nederländerna, Tjeckien, Österrike, Slovakien och Ukraina.
Analyst Groups syn på avsiktsförklaringen (LOI)
Avsiktsförklaringen med Glenmark Pharmaceuticals är den andra LOI:n inom loppet av en vecka, vilket signalerar en accelererande kommersialiseringstakt och ett tilltagande intresse för Zeqmelit® från etablerade läkemedelsaktörer.
Glenmark är ett globalt verksamt bolag med närvaro i över 80 länder, en årsomsättning om ca 14,7 mdSEK, och besitter såväl operativ kapacitet som regulatorisk erfarenhet för att framgångsrikt hantera lokala lanseringar av nya läkemedel. LOI:n omfattar sex europeiska länder – Tyskland, Nederländerna, Tjeckien, Österrike, Slovakien och Ukraina – med en sammantagen befolkning om över 160 miljoner människor. Detta kan jämföras med AcuCorts nuvarande nordiska hemmamarknad, vars befolkning uppgår till sammanlagt ca 28 miljoner.
Givet den markanta ökningen i adresserbar marknad som ett konkret avtal skulle innebära, där även en låg marknadsandel har potential att generera betydande intäktsbidrag, bedömer vi att ett eventuellt bindande avtal skulle utgöra en tydlig värdedrivare. Även om några volym- eller intäktsnivåer ännu inte kommunicerats, väger det signalvärde som följer av avsiktsförklaringen med Glenmark tungt. Tillsammans med den nyligen offentliggjorda LOI:n med Lunatus förstärks bilden av Zeqmelit® som en differentierad och internationellt gångbar produkt med ljusa framtidsutsikter.
Avsiktsförklaring (LOI) med Glenmark Pharmaceuticals
AcuCort har tecknat en avsiktsförklaring (Letter of Intent, LOI) med det globala läkemedelsbolaget Glenmark Pharmaceuticals, avseende distribution och marknadsföring av Zeqmelit® i sex europeiska länder: Tyskland, Nederländerna, Tjeckien, Österrike, Slovakien och Ukraina. Glenmark Pharmaceuticals är en väletablerad aktör inom läkemedelsindustrin med global närvaro i över 80 länder, däribland flera nyckelmarknader såsom Indien, Nordamerika och Europa. Glenmark utgör således en stark och erfaren partner med ett omfattande distributionsnätverk och god lokal marknadskännedom inom samtliga marknader som LOI:n omfattar, vilket bådar gott för kommersialiseringen av Zeqmelit®, förutsatt att ett bindande avtal ingås.
Den nyligen ingångna avsiktsförklaringen markerar ett första formellt steg mot ett potentiellt distributionsavtal med Glenmark Pharmaceuticals, som avses ansvara för marknadsföring och försäljning av Zeqmelit® på de aktuella marknaderna. Även om ett LOI i regel inte är juridiskt bindande, utgör det ett ömsesidigt åtagande att verka mot ett framtida avtal och innebär att parterna är eniga om de grundläggande villkoren. Inom läkemedelssektorn fungerar en avsiktsförklaring ofta som ett strukturerat startskede inför ingående av licens- eller distributionsavtal.
Ambitionen är att slutföra förhandlingarna och ingå ett kommersiellt avtal under år 2025, med målsättningen att framgångsrikt etablera Zeqmelit® i de sex aktuella europeiska marknaderna.
Sammanfattningsvis anser Analyst Group etableringen av ännu en strategisk avsiktsförklaring markerar ett växande internationellt momentum för AcuCort, där Glenmark Pharmaceuticals nu adderas till listan över potentiella kommersiella samarbetspartners. Enligt Analyst Groups bedömning utgör LOI:n ett tydligt styrketecken, då den visar att Zeqmelit® attraherar intresse från väletablerade aktörer med dokumenterad kapacitet att driva läkemedelslanseringar i större, reglerade marknader. Samtidigt bör det understrykas att värdet i detta samarbete fortsatt är villkorat, det är först om ett bindande avtal ingås som reella finansiella implikationer aktualiseras. Givet den markanta ökningen i adresserbar marknad som ett sådant avtal skulle innebära, ser vi ett potentiellt kommersiellt avtal som en betydande värdedrivare att bevaka under år 2025.
Om Glenmark Pharmaceuticals
Glenmark Pharmaceuticals är ett globalt läkemedelsföretag med huvudkontor i Indien, verksamt inom varumärkesläkemedel, generika och receptfria produkter. Bolaget har särskilt fokus på terapiområdena andningsvägar, dermatologi och onkologi. Glenmark driver fyra forsknings- och utvecklingscentra samt tio produktionsanläggningar med global närvaro, fördelade över fem kontinenter. Företaget är verksamt i över 80 länder, med stark närvaro i Indien, Nordamerika och Europa. Glenmark omsätter ca 14,7 mdSEK LTM, med ett EBITDA-resultat om ca 2,6 mdSEK, motsvarande en EBITDA-marginal om ca 18 %.
Kommentar på AcuCorts avsiktsförklaring (LOI) med Lunatus avseende Mellanöstern och Gulfstaterna
2025-06-10
Den 10 juni 2025 meddelade AcuCort (”AcuCort” eller ”Bolaget”) att Bolaget har ingått en avsiktsförklaring (LOI) med det Dubai-baserade bolaget Lunatus, avseende distribution och marknadsföring av läkemedlet Zeqmelit® i Mellanöstern och Gulfstaterna.
Analyst Groups syn på avsiktsförklaringen (LOI)
Den ingångna avsiktsförklaringen utgör ett strategiskt viktigt steg i AcuCorts internationaliseringsarbete och stärker förutsättningarna för att etablera Zeqmelit® på nya geografiska marknader med betydande tillväxtpotential. Initiativet ligger i linje med AcuCorts ambition att bredda Bolagets kommersiella närvaro utanför hemmamarknaden Norden och bekräftar att etablerade marknadsaktörer ser ett tydligt värde i produkten.
Förutsatt att ett slutligt avtal tecknas, erbjuder partnerskapet med Lunatus en skalbar och kapitaleffektiv väg till marknaden, där AcuCort kan dra nytta av en etablerad aktörs lokala distributionsnätverk utan behov av att bygga upp egen säljkapacitet inom regionen.
Avsiktsförklaringar utgör ett vedertaget inslag i affärsutvecklingsprocessen inom läkemedelsindustrin, och Analyst Group bedömer att sannolikheten är god för att LOI:n konverteras till ett kommersiellt avtal under innevarande år. Trots att några konkreta volymer eller intäktsnivåer ännu inte har kommunicerats, signalerar affären ett tydligt marknadsintresse från större regionala aktörer, vilket stärker bilden av Zeqmelit® som en kommersiellt attraktiv produkt med internationell relevans.
Avsiktsförklaring (LOI) med Lunatus
AcuCort har tecknat en avsiktsförklaring (Letter of Intent, LOI) med det Dubai-baserade läkemedelsbolaget Lunatus, avseende distribution och marknadsföring av Zeqmelit® i Mellanöstern och Gulfstaterna. Lunatus är en etablerad regional aktör med dokumenterad erfarenhet av att introducera och kommersialisera läkemedel genom partnerskap med globala läkemedelsbolag, däribland Abbott Diagnostics och Boston Scientific.
LOI:n markerar ett första steg mot ett potentiellt distributionsavtal, där Lunatus skulle ansvara för marknadsföring och försäljning av Zeqmelit® i regionen. Initiativet är i linje med AcuCorts strategi att expandera Bolagets globala närvaro och tillgängliggöra Zeqmelit® i marknader med växande behov av effektiva behandlingar för akuta allergiska reaktioner.
Ett LOI är i regel inte juridiskt bindande men uttrycker en ömsesidig ambition att ingå ett framtida avtal, där en avsiktsförklaring ofta används som ett inledande steg inför licens- eller distributionsavtal inom läkemedelssektorn. Parterna planerar nu att slutföra förhandlingar om ett kommersiellt avtal under år 2025, med målsättningen är att etablera Zeqmelit® på flera nyckelmarknader i regionen framgent.
Sammanfattningsvis anser Analyst Group att LOI:n med Lunatus utgör ett strategiskt viktigt steg i AcuCorts internationaliseringsfas, där Bolaget är väl positionerat att kapitalisera på nya geografiska tillväxtmöjligheter. Genom ett potentiellt kommersiellt avtal med en väletablerad regional aktör med dokumenterad distributionskapacitet får AcuCort tillgång till en skalbar och kapitaleffektiv marknadsmodell, vilket både minskar den operationella risken och påskyndar möjligheten till kommersiell etablering utanför Norden. Avsiktsförklaringen bedöms även fungera som en validerande referens, vilket kan bana väg för ytterligare affärer, då Zeqmelit® fortsätter att stärka positionen som en konkurrenskraftig behandling vid svåra och akuta allergiska reaktioner.
Om Lunatus
Lunatus är ett privat läkemedelsföretag baserat i Dubai, grundat år 2003. Bolaget har etablerat sig som en ledande aktör inom marknadsföring och distribution av läkemedel i Mellanöstern och Gulfregionen. Genom partnerskap med över 40 internationella läkemedelsbolag har Lunatus byggt upp en bred portfölj med ca 300 produktlinjer inom flera terapiområden, anpassade för att möta regionens växande behov inom hälso- och sjukvård.
Med över 250 anställda och kontor i flera länder erbjuder Lunatus en helhetslösning som omfattar regulatorisk rådgivning, försäljning, marknadsföring och logistik. Företaget har en dokumenterad förmåga att framgångsrikt introducera nya produkter på marknaden, samt att utveckla och upprätthålla starka och lönsamma varumärken över tid. Med lokal marknadskännedom, regulatorisk expertis och etablerade kommersiella kanaler utgör Lunatus en attraktiv samarbetspartner för bolag som vill expandera i regionen.
Kommentar på AcuCorts läkemedel Zeqmelit® som har registrerats som varumärke i Kanada
2025-05-26
Den 26 maj 2025 meddelade AcuCort (”AcuCort” eller ”Bolaget”) att Bolagets läkemedel Zeqmelit® har registrerats som varumärke i Kanada.
Analyst Groups syn på varumärkesskyddet
Analyst Group betraktar det erhållna varumärkesskyddet för Zeqmelit® i Kanada som ytterligare en indikation på att den internationella expansionen utvecklas i rätt riktning, framförallt i Nordamerika. Även om skyddet utgör en tidig milstolpe i en potentiell lansering på den kanadensiska marknaden, är det en viktig komponent då det stärker möjligheterna att långsiktigt etablera produkten.
Även om vi i dagsläget inte inkluderar den kanadensiska marknaden i våra finansiella prognoser, ser vi detta som en framtida option. I takt med att AcuCort successivt breddar Bolagets geografiska närvaro kan det på sikt skapa förutsättningar för nya intäktsströmmar.
Varumärkesskyddet i Kanada
Den kanadensiska varumärkesmyndigheten har beviljat AcuCorts läkemedel Zeqmelit® varumärkesskydd på den kanadensiska marknaden, giltigt till den 9 januari 2033. I och med detta är Zeqmelit® nu registrerat som varumärke i samtliga EU-länder samt i Norge, Storbritannien, Schweiz, Australien, Indien, Israel, Kina, Japan, USA – och nu även Kanada.
Vår syn på AcuCort som investering
Med en framgångsrik företrädesemission i ryggen, som tillförde AcuCort ca 43,4 MSEK, står Bolaget väl positionerat att ta nästa kliv i den kommersiella utvecklingen. Som ett led i denna utveckling för Bolaget nu ett flertal långtgående dialoger med potentiella distributions- och licenspartners på detaljnivå, bl.a. i Tyskland, Frankrike och Storbritannien. De två nyligen erhållna uppföljningsorderna från Unimedic Pharma, varav en markerar inträdet på den danska marknaden, utgör ytterligare ett kvitto på den växande efterfrågan på Zeqmelit®. Med en rad värdedrivande triggers framgent, däribland ytterligare uppföljningsorders i Norden, regulatoriska framsteg och potentiella samarbetsavtal, väntar ett händelserikt år 2025 med goda förutsättningar för fortsatt kommersiell framgång.
Genom en DCF- och rNPV-värdering, samt en WACC om 11,8 % härleds ett riskjusterat nuvärde (börsvärde) om ca 256 MSEK i ett Base scenario, motsvarande 1,1 kr per aktie.
Läs vår senaste analys av AcuCort här.
Kommentar på AcuCorts nya order på Zeqmelit®
2025-05-13
Den 12 maj 2025 meddelade AcuCort (”AcuCort” eller ”Bolaget”) att Bolaget mottagit en ny order på Zeqmelit® från dess nordiska distributionspartner, Unimedic Pharma. Ordervärdet uppgår till ca 60,4 tEUR, motsvarande ca 656 tSEK, och avser den nordiska marknaden.
Analyst Groups syn på den nya ordern
Den mottagna ordern utgör den tredje i raden från Unimedic Pharma och förstärker bilden av ett växande marknadsintresse för Zeqmelit®. I kombination med ordern om 18,5 tEUR, motsvarande ca 200 tSEK, som erhölls under Q2-25 för den danska marknaden, anser Analyst Group att detta bekräftar en ökande efterfrågan. Dessa ordrar signalerar att Zeqmelit® successivt vinner mark i en bransch där införsäljningscykler i regel sett är utdragna, och där nya behandlingsalternativ ofta möter initial tröghet. Återkommande beställningar i ett tidigt skede bedömer vi således som ett styrketecken, vilket även stödjer vår tes om att Norden har förutsättningar att agera språngbräda för AcuCorts bredare kommersialiseringsstrategi.
Samarbetet med Unimedic Pharma och den nya ordern
Partnerskapet med Unimedic Pharma, som ingicks under Q3-23, omfattar samtliga nordiska länder – Sverige, Norge, Danmark och Finland – där Unimedic ansvarar för försäljning och marknadsföring av Zeqmelit®. Unimedic är ett svenskt specialistläkemedelsföretag med bred närvaro i norra Europa och erfarenhet inom flera terapiområden.
Sedan den första ordern om 675 tSEK inkom under Q1-24 har två ytterligare ordrar mottagits under Q2-25. Den första, uppgående till ca 200 tSEK, markerade inträdet på den danska marknaden, med planerad försäljningsstart i juni. Den andra, som mottogs den 12 maj, omfattar den nordiska marknaden i bred bemärkelse, till ett värde om ca 656 tSEK.
Sedan lanseringen av Zeqmelit® på nordiska apotek under Q3-24 har läkemedlet tagits emot väl av såväl Bolagets primära målgrupp, astma- och allergiläkare, som av slutpatienterna. Denna utveckling stärker AcuCorts position på den nordiska hemmamarknaden och skapar gynnsamma förutsättningar inför framtida marknadsexpansion.
Sammanfattningsvis anser Analyst Group att den tredje ordern på Zeqmelit® från Unimedic Pharma bekräftar ett växande marknadsintresse och stärker bilden av en gradvis kommersiell etablering i Norden. Vi bedömer återkommande ordrar i ett tidigt skede som ett styrketecken i en annars trögrörlig bransch, och utvecklingen stödjer tesen att den nordiska marknaden utgör en strategiskt viktig språngbräda för AcuCorts fortsatta internationella expansion.
Med ett starkt operativt momentum, en pågående allergisäsong och flertalet långtgående dialoger med potentiella distributions- och licenspartners på detaljnivå befinner sig Bolaget i en intensiv kommersiell fas. I kombination med fortsatta regulatoriska framsteg och kommande publikationer av vetenskapliga artiklar i ledande internationella medicinska tidskrifter bäddar detta för ett händelserikt år 2025, med flera värdedrivande katalysatorer inom räckhåll.
Vi kommer att återkomma med en uppdaterad aktieanalys av AcuCort inom kort.
Kommentar på AcuCorts Q1-rapport
2025-05-08
AcuCort (”AcuCort” eller ”Bolaget”) har publicerat Bolagets delårsrapport för det första kvartalet 2025.
Följande är några punkter som vi valt att belysa i samband med rapporten:
- Kapitaltillskott om 43,4 MSEK möjliggör accelererad expansion
- Ny order på Zeqmelit® markerar det stundande inträdet på den danska marknaden
- Intensifierade diskussioner med potentiella licens- och distributionspartners
- Lovande studieresultat stärker klinisk trovärdighet och förhandlingsposition
- Förnyat marknadsgodkännande för Zeqmelit® i Norden
- Kostnadskontroll upprätthålls trots ökade kommersiella satsningar
- Stärkt balansräkning och potentiell optionslösen skapar finansiellt handlingsutrymme
Betydande kapitaltillskott stärker förutsättningarna för internationell expansion
Under Q1-25 genomförde AcuCort en framgångsrik företrädesemission som tecknades till hela 160,6 %, vilket resulterade i en nettolikvid om ca 43,4 MSEK. Det starka utfallet, där styrelse, VD och större ägare stod för betydande teckningsåtaganden, vittnar om ett brett och fördjupat förtroende för Bolagets strategi och framtidsutsikter. Kapitaltillskottet ger AcuCort finansiellt utrymme att intensifiera de kommersiella satsningarna, med fokus på att omvandla det momentum som skapats av Zeqmelit®-lanseringen i Norden till konkreta partnerskap på den europeiska och globala marknaden.
Ny order på Zeqmelit® – försäljningsstart på den danska marknaden i juni
Under inledningen av Q2-25 mottog AcuCort en ny order på Zeqmelit® från Bolagets nordiska distributionspartner, Unimedic Pharma, till ett värde om ca 18,5 tEUR, där försäljningsstart är planerad till juni månad. Ordern markerar den stundande lanseringen i Danmark, en naturlig förlängning av Bolagets etablering på den nordiska hemmarknaden.
Även om ordervärdet i sig är relativt blygsamt, bedömer vi att det strategiska värdet är desto större. Ordern bekräftar att distributionsarbetet fortlöper enligt plan och att Zeqmelit® fortsätter att uppfattas som ett relevant behandlingsalternativ inom sitt indikationsområde. Då införsäljning av läkemedel inom akut astma och allergi ofta sker successivt, ser vi det som särskilt positivt att efterfrågan nu återkommer, vilket stärker vår tilltro till en långsiktig etablering.
Detta är den andra registrerade ordern från Unimedic Pharma, och med tidigare lanseringar i Sverige, Norge och Finland under Q3-24, framstår den danska marknaden som ett logiskt nästa steg för att stärka Bolagets närvaro ytterligare i Norden, vilket i förlängningen förväntas fungera som en språngbräda för den globala kommersialiseringen. I en presentation av VD Jonas Jönmark i anslutning till Q1-rapporten betonades även att teamet förbereder en ytterligare uppföljningsorder på den nordiska marknaden, vilket utgör en potentiell trigger att beakta under kommande kvartal. Vidare lyfter Jonas det positiva mottagandet inom läkarkåren, samtidigt som han understryker att en central komponent i den kommande upptrappningen ligger i att patienterna förnyar sina allergirecept, vilket är en förutsättning för att Zeqmelit® ska kunna förskrivas.
Fler marknader står näst på tur i den internationella expansionen
Bolaget framhåller att diskussionerna med potentiella samarbetspartners har intensifierats, med särskilt fokus på de europeiska nyckelmarknaderna Tyskland, Frankrike och Storbritannien, där dialoger nu förs på detaljnivå. I detta sammanhang utgör kapitaltillskottet från den lyckade emissionen en central förutsättning för att kunna finansiera både expansionsprocesserna och de regulatoriska konsulter som krävs i takt med en mer offensiv kommersialiseringsstrategi. Vidare för AcuCort dialoger med aktörer på marknader utanför Europa (Rest of the World), däribland Kina, Indien och Australien, även om det initiala fokuset primärt ligger på expansion inom Europa.
Även den amerikanska marknaden bedöms rymma betydande potential och utgör en viktig komponent i AcuCorts strategi. I slutet av Q4-24 lämnade AcuCort in en Initial Pediatric Study Plan (iPSP) till den amerikanska läkemedelsmyndigheten FDA, ett obligatoriskt steg i ansökningsprocessen mot ett framtida godkännande. Den efterföljande 90-dagarsgranskningen har dock dragit ut på tiden, vilket enligt Bolaget beror på interna processer hos FDA. När utlåtandet väl inkommit kan AcuCort gå vidare med att lämna in en formell NDA-ansökan (New Drug Application). Målsättningen är att detta ska ske under år 2025, vilket utgör en strategiskt viktig milstolpe och potentiell trigger för AcuCorts vidare kommersialisering. Noterbart i sammanhanget är att AcuCort har beviljats en så kallad Small Business Waiver (SBW), vilket innebär att Bolaget är undantaget från ansökningsavgiften för en NDA-ansökan. I normala fall uppgår denna kostnad till ca 16 MSEK, och processen enligt den så kallade 505(b)(2)-processen tar i regel omkring 12 månader.
Lovande resultat i Fas IV-studie stärker trovärdighet och förhandlingsläge
Under Q4-24 slutfördes Bolagets Fas IV-studie, där insamlade data har analyserats och sammanställts i en studierapport med lovande preliminära resultat för Zeqmelit®. Nästa steg är att utarbeta vetenskapliga artiklar för publicering i ledande internationella medicinska tidskrifter, ett arbete som inte bara stärker läkemedlets kliniska trovärdighet, utan också utgör ett viktigt verktyg i de pågående kommersiella förhandlingarna med potentiella samarbetspartners.
Det har tidigare nämnts, men förtjänar att återigen understrykas: studien är inte ett regulatoriskt krav för kommersialiseringen. Istället fungerar den som ett strategiskt stöd i Bolagets marknadsföringsarbete, särskilt i kontakten med den primära målgruppen, astma- och allergiläkare. Genom att lyfta fram patienternas upplevda trygghet och erfarenheter av Zeqmelit® bidrar studieresultaten till att förankra läkemedlet i klinisk praktik och skapa förtroende hos förskrivande läkare.
Förnyat marknadsgodkännande för Zeqmelit® i Sverige, Norge och Danmark
Under kvartalet erhöll AcuCort förnyade marknadsgodkännanden för Zeqmelit® i Sverige, Norge och Danmark. Läkemedlet godkändes initialt i Sverige år 2020, samt i Norge och Danmark år 2022, samtliga med tidsbegränsade tillstånd, vilket är standardpraxis för nya läkemedel. De nya godkännandena gäller tills vidare, vilket utgör en viktig regulatorisk bekräftelse på läkemedlets säkerhets- och effektprofil. Även om besluten var väntade, markerar de en viktig milstolpe som stärker Zeqmelit®s position på den nordiska marknaden och skapar stabilitet i det fortsatta kommersiella arbetet.
Nettoomsättning och kostnadsbas
Ingen nettoomsättning har rapporterats under det första kvartalet. Vi förväntar oss däremot att den nya ordern om ca 18,5 tEUR, som erhölls under Q1-25, kommer att redovisas som omsättning under kommande kvartal.
Under Q1-25 uppgick Bolagets totala rörelsekostnader (exkl. avskrivningar) till ca 5,9 MSEK (4,7), vilket motsvarar en ökning om 23,4 % i jämförelse med Q1-24, men en minskning om 21 % Q-Q, då rörelsekostnaderna uppgick till ca 7,4 MSEK.
Analyst Group bedömer att den ökade kostnadsmassan på årsbasis är ett naturligt led i takt med att Bolaget intensifierar de kommersiella aktiviteterna kring Zeqmelit®. Kostnadsökningen hänförs bl.a. till utvecklingsarbete kopplat till produktion och processer inför kommersialisering, samt till insatser från regulatoriska konsulter. Detta till trots betonar AcuCort att rörelsekostnaderna kom in något lägre än prognostiserat för Q1-25, vilket ytterligare understryker att Bolaget, trots en intensifierad kommersiell satsning, fortsatt uppvisar god kostnadskontroll.
Under Q1-25 har ca 1,4 MSEK i utvecklingsutgifter aktiverats under immateriella tillgångar, kopplat till kostnader för att erhålla godkännande och registrering i USA, samt till studier och utvecklingsarbete kring produktionsprocessen för Zeqmelit®. Samtidigt uppgick avskrivningarna av de tidigare aktiverade immateriella tillgångarna, vars avskrivningar inleddes under Q4-24, till ca 2,1 MSEK under Q1-25.
Solid finansiell position i spåren av den lyckade emissionen
Vid utgången av Q1-25 uppgick kassan till ca 38,4 MSEK, vilken har stärkts avsevärt till följd av den framgångsrika företrädesemissionen, vilket skapar finansiellt spelrum för Bolaget att driva dialoger med potentiella licenstagare, samt övriga initiativ kopplade till produktion, studier, kommersialiseringsprocesser och kostnader för regulatoriska konsulter.
AcuCort har uppvisat en genomsnittlig operativ kapitalförbrukning om ca -2,1 MSEK/månad under Q1-25, och med kvartalets investeringar i beaktning uppgår det negativa fria kassaflödet (FCFF) till ca -2,6 MSEK/mån. Jämfört med föregående kvartal (Q4-24) har den operativa kapitalförbrukningen således ökat, då den uppgick till -0,4 MSEK per månad. Förändringen förklaras i huvudsak av en negativ rörelsekapitalförändring, vilken kan variera avsevärt mellan kvartal beroende på exempelvis utbetalningar till leverantörer och uppbyggnad av kortfristiga tillgångar.
Genom inlösen av teckningsoptioner av serie TO2 under Q2-25, som vid full teckning kan tillföra Bolaget ytterligare 23,8 MSEK, kan balansräkningen stärkas ytterligare. Detta skapar ett förstärkt finansiellt utrymme för AcuCort att möta den ökande efterfrågan och exekvera på Bolagets strategiska initiativ framgent.
Sammanfattningsvis anser Analyst Group att AcuCort, med en avsevärt stärkt balansräkning i spåren av den fulltecknade företrädesemissionen, ett växande intresse från potentiella distributions- och licenspartners samt lansering i Danmark, har goda förutsättningar att ta nästa steg i Bolagets internationella tillväxtresa. Även om uppföljningsordern från Unimedic Pharma lämnade mer att önska i termer av ordervärde, bedömer vi att det strategiska värdet väger tyngre, något som ytterligare stärker vår tes om att den nordiska hemmamarknaden fungerar som en viktig språngbräda för den globala kommersialiseringen framgent. Fortsatta uppföljningsorder på den nordiska marknaden, kommersiella avtal med distributions- och licenspartners, publicering i vetenskapliga tidskrifter samt ett kommande utlåtande från FDA – vilket möjliggör inlämning av en formell NDA-ansökan – utgör samtliga betydande triggers att bevaka under året.
Vi kommer att återkomma med en uppdaterad aktieanalys av AcuCort.
Kommentar på AcuCorts nya order på Zeqmelit® samt expansion i Danmark
2025-04-02
Den 1 april 2025 meddelade AcuCort (”AcuCort” eller ”Bolaget”) att Bolaget mottagit en ny order på Zeqmelit® från dess nordiska distributionspartner, Unimedic Pharma. Ordervärdet uppgår till 18,5 tEUR och innebär att Zeqmelit® inom kort blir tillgängligt på den danska marknaden, en viktig milstolpe för AcuCorts expansionsresa.
Analyst Groups syn på den nya ordern och expansionen till Danmark
Den nya ordern från Unimedic Pharma innebär inte bara en konkret upptrappning i AcuCorts kommersialiseringsstrategi, den utgör även en tydlig indikation på att lanseringsarbetet fortskrider enligt plan. Att Zeqmelit® inom kort introduceras på ytterligare en nordisk marknad stärker Bolagets geografiska fotavtryck, samtidigt som det understryker potentialen i Norden som en strategisk språngbräda för vidare internationell expansion.
Ordervärdet om 18,5 tEUR må vara relativt blygsamt, men dess signalvärde och strategiska betydelse väger desto tyngre. Den uppföljande ordern från Bolagets nordiska distributionspartner signalerar ett växande marknadsintresse och tyder på att Bolagets kärnmålgrupp, astma- och allergiläkare, ser ett faktiskt behov för den typ av administrationsform Zeqmelit® erbjuder. Det är ett styrkebesked i en bransch som ofta präglas av långa och trögrörliga införsäljningscykler, där nya behandlingsalternativ inte sällan möter visst initialt motstånd. Att Unimedic Pharma nu lägger en andra order anser Analyst Group utgör ett starkt kvitto på Zeqmelit®s marknadsrelevans. Det stärker bilden av att produkten har ett reellt existensberättigande och att tidigare marknadsföringsinsatser börjar bära frukt.
Med flera långt-gångna dialoger med potentiella samarbetspartners i ryggen och en stundande allergisäsong som förväntas driva efterfrågan ytterligare, bedömer Analyst Group att AcuCort står väl positionerat för att ta nästa steg i Bolagets kommersiella resa.
Zeqmelit® introduceras i Danmark – ytterligare order från Unimedic Pharma
AcuCort fortsätter rulla ut Zeqmelit® i Norden och meddelar att Bolaget mottagit en ny order från distributionspartnern Unimedic Pharma, värd 18,5 tEUR. Ordern markerar starten för den danska lanseringen och utgör ett betydande steg i Bolagets strategi att successivt stärka närvaron på den nordiska hemmamarknaden.
Det strategiska samarbetet med Unimedic Pharma, som etablerades under Q3-23, omfattar distribution i Sverige, Norge, Danmark och Finland. Efter en initial order om 675 tSEK under Q1-24 lanserades Zeqmelit® på apotek i Sverige, Norge och Finland under Q3-24. Den nya ordern visar dels att distributionsavtalet omsätts i praktiken, dels att lanseringen fortskrider enligt plan.
Att Zeqmelit® nu tar klivet in på den danska marknaden innebär inte bara en geografisk expansion, det understryker även Bolagets operativa momentum.
Sammanfattningsvis anser Analyst Group att ordern och lanseringen i Danmark markerar viktiga milstolpar i Bolagets kommersialiseringsstrategi. Trots det relativt begränsade ordervärdet väger det symboliska värdet tungt, då det signalerar en växande efterfrågan och bekräftar Zeqmelit®s relevans bland Bolagets primära målgrupp. Med flera pågående partnerdialoger, en stärkt finansiell ställning i ljuset av den nyligen genomförda emissionen och en stundande allergisäsong, bedöms AcuCort vara väl positionerat för nästa steg i Bolagets tillväxtresa.
Kommentar på AcuCorts Q4-rapport
2025-02-24
AcuCort (”AcuCort” eller ”Bolaget”) har publicerat Bolagets delårsrapport för det fjärde kvartalet 2024.
Följande är några punkter som vi valt att belysa i samband med rapporten:
- Kraftigt övertecknad emission tillför Bolaget ytterligare tillväxtkapital
- Den globala kommersialiseringsstrategin skapar ett smörgåsbord av triggers framgent
- Inlämnad iPSP – Bolaget tar kliv i processen att ansöka om FDA-godkännande
- Beviljas förlängd SME-status – medför lägre kostnader
- Positiva resultat från Fas IV-studie (ZEQ001)
- Medverkan på den vetenskapliga konferensen ISPOR – viktigt marknadsföringsforum
- Ökade rörelsekostnader – naturlig följd i takt med att Bolaget intensifierar det kommersiella arbetet
- Den framgångsrika emissionen skapar finansiell trygghet
Övertecknad företrädesemission möjliggör fortsatta tillväxtsatsningar
Under Q4-24 och efter kvartalets utgång genomförde AcuCort en företrädesemission, där det starka intresset resulterade i att emissionen tecknades till ca 76,6 MSEK, motsvarande en teckningsgrad om hela 160,6 %. Genom den kraftigt övertecknade företrädesemissionen tillförs Bolaget ca 47,7 MSEK före emissionskostnader, vilka beräknas uppgå till högst 6,6 MSEK, inklusive ersättning till bottengaranter om 3,3 MSEK. Detta resulterar i en nettolikvid om ca 41,1 MSEK, vilket skapar finansiellt utrymme för att accelerera Bolagets tillväxtinitiativ framgent. Analyst Group vill även lyfta fram de betydande teckningsåtagandena från styrelse, VD och större aktieägare i samband med emissionen, vilket utgör en stark signal om nyckelpersoners förtroende för AcuCorts framtidsutsikter. Med en stärkt balansräkning står AcuCort väl positionerat att kapitalisera på det momentum som skapats genom den nordiska lanseringen av Zeqmelit under Q3-24, med fokus på att säkra lukrativa samarbetsavtal inom EU och ROW (rest of the world) under H1-25. Givet det växande intresset från potentiella distributions- och licenspartners förväntas detta utgöra en katalysator för accelererad marknadspenetration och framtida tillväxt.
Tydlig strategi för en lyckad global kommersialisering – smörgåsbord av triggers framgent
De nordiska hemmamarknaderna utgör en strategisk plattform för Bolagets internationella expansion, vilken nu väntas accelerera med stöd av det tillväxtkapital som tillförts genom den övertecknade emissionen. Bolagets primära fokus framgent är att säkra marknadsgodkännanden i nyckelmarknader såsom Tyskland, Frankrike, Storbritannien, Polen, Italien och Spanien, samt i USA och utvalda regioner globalt, inklusive Australien, Kina, Indien, Sydamerika och Sydafrika.
Parallellt fortlöper långt gångna diskussioner med potentiella samarbetspartners inom dessa marknader avseende licens- och distributionsavtal, där målsättningen är att sluta flera strategiska avtal under år 2025. Det är värt att notera att partnerskap ofta etableras redan innan regulatoriska godkännanden erhålls, vilket möjliggör en snabbare marknadsetablering.
Med en skalbar och industriellt optimerad produktionskapacitet genom den franska kontraktstillverkaren Adhex Pharma, är AcuCort väl positionerade för att successivt öka produktionsvolymerna i linje med växande kommersiella åtaganden. Sammantaget står Bolaget inför ett händelserikt år 2025, där en rad katalysatorer har potential att generera betydande aktieägarvärde.
Ett steg närmare potentiellt FDA-godkännande
I december 2024 lämnade AcuCort in en Initial Pediatric Study Plan (iPSP) till den amerikanska läkemedels- och livsmedelsmyndigheten, FDA, som ett led i processen att ansöka om FDA-godkännande för Zeqmelit® under år 2025. En iPSP är ett obligatoriskt dokument som läkemedelsbolag måste tillhandahålla för att beskriva sina planer på att utvärdera säkerhet och effektivitet av ett läkemedel inom pediatriska populationer. FDA har 90 dagar på sig att granska den inlämnade planen och ge sitt utlåtande, och därefter har AcuCort möjlighet att lämna in en formell NDA-ansökan (New Drug Application). En NDA-ansökan enligt en så kallad 505(b)(2) process tar i regel ca 12 månader från dess att den lämnas in, och processen kostar drygt USD 2m. Noterbart är dock att AcuCort har fått en så kallad Small Business Waiver (SBW) godkänd, vilket innebär att Bolaget inte behöver betala den annars kostsamma NDA-ansökningsavgiften.
Den amerikanska marknaden är av signifikant strategisk betydelse för AcuCort, inte enbart på grund av att det är världens största läkemedelsmarknad med en omfattande försäljningspotential, utan också för dess långsiktiga betydelse för Bolagets globala etablering. Givet att FDA håller den utlovade tidsplanen och återkommer med sitt utlåtande inom 90 dagar, utan krav på kompletteringar, siktar AcuCort på att lämna in en fullständig NDA-ansökan under H2-25, vilket utgör en betydande trigger framgent.
Förlängd SME-status förväntas medföra reducerade kostnader
I början av Q4-24 beviljades AcuCort förlängd SME-status av EMA, vilket innebär att Bolaget fortsatt klassificeras som ett SME-bolag av myndigheten fram till utgången av Q4-25. Denna status medför betydande fördelar, då AcuCort helt eller delvis undantas från avgifter relaterade till regulatoriska ansökningar kopplade till försäljning och marknadsföring av läkemedel inom EU och EEA. Detta är särskilt värdefullt i det nuvarande skedet, då Bolaget har säkrat nödvändigt tillväxtkapital för att tillvarata dessa möjligheter. Analyst Group bedömer detta som en strategiskt fördelaktig utveckling, då den förväntas minska kostnaderna vid marknadsregistreringar och därigenom reducera Bolagets operativa kapitalförbrukning i takt med att marknadsföringsinsatserna inom EU och EEA intensifieras.
Positiva resultat från Fas IV-studie (ZEQ001)
Under Q4-24 avslutades AcuCorts Fas IV-studie, ZEQ001, där samtliga patienter nu har genomgått behandlingen. Efter kvartalets utgång meddelade AcuCort att studieresultaten varit lovande för Zeqmelit®, och arbetet har nu inletts med att sammanställa vetenskapliga artiklar för publicering i ledande internationella tidskrifter. De positiva resultaten förväntas utgöra en stabil grund för vetenskaplig kommunikation framåt, vilket stärker AcuCorts lanseringsstrategi. Studien är, som tidigare nämnts, inte ett regulatoriskt krav för kommersialiseringen av Zeqmelit®, men fungerar som ett värdefullt marknadsföringsverktyg. Genom att ge insikter om patienternas erfarenheter och trygghet med läkemedlet underlättar den kommunikationen med astma- och allergiläkare, Bolagets primära målgrupp.
Medverkat på den vetenskapliga konferensen ISPOR i Barcelona
Under Q4-24 deltog AcuCort vid den vetenskapliga konferensen ISPOR Europe i Barcelona, där Bolaget presenterade studien Swedish Allergists’ View on the Role of Cortisone and the Formulation (Tablets or Self-Dissolving Film) for the Treatment of Acute Allergic Reactions. Studien, genomförd år 2023 via intervjuer med erfarna allergologer, vilken syftade till att kartlägga kortisonets användning vid akuta allergiska reaktioner samt de praktiska utmaningarna med traditionella kortisontabletter. Resultaten visar att allergologer ser behandlingssituationen (tabletter) som suboptimal, då patienter ofta är ensamma, stressade eller saknar medicin och vatten. Samtliga deltagare identifierade tydliga fördelar med Zeqmelit® jämfört med kortisontabletter, främst tack vare den enkla administreringen och en förbättrad följsamhet. Analyst Group bedömer ISPOR som ett strategiskt viktigt forum för att nå astma- och allergiläkare, vars förskrivningsbenägenhet är avgörande för Zeqmelit®s marknadsacceptans och framtida försäljning.
Nettoomsättning och kostnadsbas
Ingen nettoomsättning har rapporterats under det fjärde kvartalet. Då Bolagets distributionspartner, Unimedic Pharma, ansvarar för försäljningen av Zeqmelit® på de nordiska hemmamarknaderna, medför det en slagighet i AcuCorts rapporterade omsättning. Likväl lyfter Bolaget fram att Zeqmelit® har mottagits väl på den nordiska marknaden, och med den stundande allergisäsongen runt hörnet förväntas försäljningen av Zeqmelit® öka.
År 2024 markerar ett banbrytande år för AcuCort, då Bolaget har tagit klivet från att vara ett utvecklingsbolag till att bli ett kommersiellt läkemedelsbolag genom en lyckad utrullning av Zeqmelit® på nordiska apotek. För helåret 2024 uppgår nettoomsättningen till 675 tSEK (0), vilket återspeglar den inneboende trögheten i läkemedelsmarknaden, där marknadsacceptans är en gradvis process snarare än en omedelbar framgång, en dynamik som dock skapar förutsättningar för långsiktiga konkurrensfördelar. Givet att den förväntade förändringen får genomslag bland Bolagets primära målgrupp, astma- och allergiläkare, bedömer Analyst Group att omsättningstillväxten kan accelerera kraftigt, en effekt som ofta kännetecknar marknader där initial etablering kräver tid, men där efterfrågan därefter snabbt kan eskalera.
Under Q4-24 uppgick Bolagets totala rörelsekostnader (exkl. avskrivningar) till 7,4 MSEK (6,7), vilket motsvarar en ökning om ca 9,7 % i jämförelse med Q4-23, samt en markant ökning Q-Q då rörelsekostnaderna uppgick till ca 4,0 MSEK. Analyst Group anser att den ökade kostnadsmassan på rörelsenivå är en naturlig följd av att Bolaget rampar upp initiativen med sikte på global kommersialisering. Kostnaderna omfattar, utöver den dagliga driften, utvecklingsarbeten kring produktion, studier och processer för kommersialisering, samt kostnader för regulatoriska konsulter. Under Q4-24 har 3 518 KSEK i utvecklingsutgifter aktiverats under immateriella tillgångar, kopplat till kostnader för att erhålla godkännande och registrering i USA, samt till studier och utvecklingsarbete kring produktionsprocessen för Zeqmelit®. Under kvartalet har Bolaget även påbörjat avskrivningar av de aktiverade immateriella tillgångarna, vilket är en redovisningsteknisk effekt och därmed inte påverkar kassaflödet.
Framgångsrik företrädesemission skapar god finansiell flexibilitet
Vid utgången av december 2024 uppgick kassan till ca 2,8 MSEK, vilken har stärkts avsevärt efter kvartalets utgång, till följd av den framgångsrika företrädesemissionen. Nettolikviden förväntas uppgå till ca 41,1 MSEK, vilket skapar finansiellt spelrum för Bolaget att driva dialoger med potentiella licenstagare, samt övriga initiativ kopplade till produktion, studier, kommersialiseringsprocesser och kostnader för regulatoriska konsulter.
AcuCort har uppvisat en genomsnittlig operativ kapitalförbrukning om ca -0,4 MSEK/månad under Q4-24, och med kvartalets investeringar i beaktning uppgår det negativa fria kassaflödet (FCFF) till ca -1,6 MSEK/mån. Jämfört med föregående kvartal (Q3-24) har den operativa kapitalförbrukningen således förbättrats, då den uppgick till -1,1 MSEK per månad. Däremot har det fria kassaflödet försämrats, från -1,3 MSEK per månad under Q3-24, till följd av ökade investeringar, något som dock lägger grunden för en framgångsrik global expansion.
Med den fulltecknade företrädesemissionen i bagaget, samt med optionsinlösen av serie TO2 under Q2-25, som maximalt kan tillföra Bolaget ytterligare 23,8 MSEK vill full teckning, har Bolaget en stark balansräkning som möjliggör för AcuCort att exekvera på den ökande efterfrågan framgent.
Sammantaget konstaterar Analyst Group att AcuCort avslutar år 2024 med viktiga strategiska framsteg och en stärkt balansräkning. Den framgångsrika företrädesemissionen, som tillför Bolaget ca 41,1 MSEK efter periodens utgång, skapar finansiellt utrymme att accelerera tillväxtinitiativ och intensifiera kommersialiseringsprocessen. Därtill har AcuCort tagit viktiga steg mot ett potentiellt FDA-godkännande genom inlämningen av en Initial Pediatric Study Plan (iPSP), vilket kan bana väg för en inlämnad NDA-ansökan under H2-25. De nordiska hemmamarknaderna förväntas spela en central roll som språngbräda för Bolagets kommande internationella expansion framgent, med särskilt fokus på nyckelmarknader såsom Tyskland, Polen, Frankrike och Storbritannien och USA. Vidare utgör uppföljningsorders från Unimedic Pharma avseende den nordiska hemmamarknaden, samt försäljningsstart på den danska marknaden, ytterligare triggers att bevaka i närtid. Med en solid finansiell grund och en produkt med unik marknadspotential står AcuCort väl rustat att kapitalisera på den ökande efterfrågan och därmed etablera en starkare global närvaro.
Vi kommer att återkomma med en uppdaterad aktieanalys av AcuCort.
Analyst Group kommenterar utfallet i AcuCorts företrädesemission samt positiva resultat från Fas IV-studie
2025-02-04
Den 3 februari 2025 meddelade AcuCort (”AcuCort” eller ”Bolaget”) utfallet i företrädesemissionen, vilken har tecknats till ca 76,6 MSEK, motsvarande en teckningsgrad om hela 160,6 %. Genom företrädesemissionen tillförs AcuCort totalt ca 47,7 MSEK före emissionskostnader. Vidare har data från Bolagets Fas IV-studie som slutfördes under Q4-24 visat på lovande resultat för Zeqmelit®, varpå arbetet nu inleds med att författa vetenskapliga artiklar för publicering i ledande internationella vetenskapliga tidskrifter.
Analyst Groups syn på utfallet samt positiva studieresultat
Företrädesemissionen tillför Bolaget ca 47,7 MSEK före emissionskostnader, och med beräknade emissionskostnader om högst ca 6,6 MSEK (inkl. ersättning för bottengaranter om 3,3 MSEK), beräknas nettolikviden uppgå till ca 41,1 MSEK. Den kraftigt övertecknade företrädesemissionen möjliggör ökade tillväxtsatsningar, vilket förväntas bana väg för ett globalt kommersiellt genombrott. Kapitalanskaffningen följer av ett ökat intresse för Zeqmelit från potentiella distributions- och licenspartners sedan den nordiska lanseringen under Q3-24. Därmed kommer kapitaltillskottet således att möjliggöra för Bolaget att exekvera på den ökade efterfrågan, vilket Analyst Group bedömer kan resultera i ytterligare avtal beträffande Bolagets nyckelmarknader i EU och ROW (Rest of the World) under H1-25.
Ytterligare en ljuspunkt att belysa i samband med emissionen är de starka teckningsåtagandena från Bolagets styrelse, VD och större aktieägare, vilket utgör ett starkt signalvärde avseende förtroendet för AcuCorts ljusa framtidsutsikter.
De positiva resultaten från Fas IV-studien förväntas utgöra en solid grund för vetenskaplig kommunikation framgent, vilket är ett viktigt stöd i AcuCorts lanseringsarbete. Den kliniska studien är som tidigare nämnts inte direkt nödvändig för kommersialiseringen av Zeqmelit®, utan fungerar huvudsakligen som ett värdefullt marknadsföringsverktyg i syfte att approchera Bolagets primära målgrupp, astma- och allergiläkare, med värdefulla insikter relaterade till patienternas erfarenheter och trygghet med Zeqmelit®.
Utfall i företrädesemissionen
Företrädesemissionen tecknades till ca 76,6 MSEK, motsvarande en teckningsgrad om 160,6 %, varav 45,9 MSEK, motsvarande 96,3 % av företrädesemissionen tecknades med stöd av uniträtter. Resterande andel, ca 30,7 MSEK och 64,3 % av företrädesemissionen tecknades utan stöd av uniträtter. Således sker ingen tilldelning till de investerare som lämnat emissionsgarantier, vilket innebär att AcuCort totalt tillförs ca 47,7 MSEK före emissionskostnader. Emissionskostnaderna beräknas uppgå till högst 6,6 MSEK, inklusive ersättning för bottengarantiåtagandet om högst 3,3 MSEK, motsvarande 14 % av det garanterade beloppet.
Företrädesemissionen medför att det totala antalet utestående aktier ökar med 95 336 040 nya aktier, från 119 170 050 aktier till 214 506 090 utestående aktier. Detta medför en utspädningseffekt om ca 44,4 % för de aktieägare som inte deltog i företrädesemissionen.
I samband med emissionen emitteras även 31 778 680 teckningsoptioner av serie TO 2, vilket berättigar innehavaren att teckna en (1) ny aktie från och med den 9 juni 2025 till och med den 20 juni 2025, till en teckningskurs om 0,75 kr per aktie. Vid fullt utnyttjande av teckningsoptionerna förväntas Bolaget erhålla ytterligare ca 23,8 MSEK före emissionskostnader, motsvarande en utspädningseffekt om ca 12,9 %.
Sammanfattningsvis anser Analyst Group att den kraftigt övertecknade emissionen visar på ett starkt förtroende gällande AcuCorts framtidsutsikter, både från befintliga ägare samt styrelse och ledning. Teckningsgraden om ca 161 % är särskilt imponerande i nuvarande marknadsklimat, då många andra bolag på de svenska smålistorna brottas med att fylla emissionerna och erhålla tillräckligt med kapital. Kapitaltillskottet förväntas stärka AcuCorts finansiella ställning avsevärt, vilket är centralt för att kunna exekvera på den ökade efterfrågan och säkerställa nödvändiga resurser för partner- och licensförhandlingar. Med en robust finansiell ställning, ökat intresse från potentiella distributions- och licenspartners, samt positiva resultat från Bolagets Fas IV-studie och efterföljande marknadsföringsverktyg i närtid, är AcuCort väl positionerade för ytterligare kliv i kommersialiseringsresan och därmed en global lansering av Zeqmelit®.
Kommentar på AcuCorts inlämnade iPSP-ansökan till FDA
2024-12-19
AcuCort (”AcuCort” eller ”Bolaget”) meddelade den 19 december år 2024 att Bolaget har lämnat in en Initial Pediatric Study Plan (iPSP) till den amerikanska läkemedels- och livsmedelsmyndigheten, FDA, som ett led i processen att ansöka om FDA-godkännande för Zeqmelit® under år 2025.
En iPSP är ett obligatoriskt dokument som läkemedelsbolag måste tillhandahålla för att beskriva sina planer på att utvärdera säkerhet och effektivitet av ett läkemedel inom pediatriska populationer. AcuCort avser att ansöka om marknadsgodkännande baserat på bioekvivalens, vilket innebär att AcuCort behöver visa att Zeqmelit® uppträder på liknande sätt i kroppen som en redan godkänd referensprodukt med samma aktiva substans, i detta fall dexametason, för att erhålla motsvarande medicinska indikationer som referensprodukten har i sin medicinska dokumentation.
FDA har 90 dagar på sig att granska den inlämnade planen och ge sitt utlåtande, och därefter har AcuCort möjlighet att lämna in en formell NDA-ansökan (New Drug Application). En NDA-ansökan enligt en så kallad 505(b)(2) process tar i regel ca 12 månader från dess att den lämnas in, och processen kostar drygt USD 2m. Noterbart är dock att AcuCort har fått en så kallad Small Business Waiver (SBW) godkänd, vilket innebär att Bolaget inte behöver betala den annars kostsamma NDA-ansökningsavgiften.
Ansvarig analytiker kommenterar
”Den amerikanska marknaden är av signifikant strategisk betydelse för AcuCort, inte enbart på grund av att det är världens största läkemedelsmarknad med en omfattande försäljningspotential, utan också för dess långsiktiga betydelse för Bolagets globala etablering. Att Bolaget nu har lämnat in en iPSP utgör en milstolpe i processen mot att erhålla FDA-godkännande för Zeqmelit®. Givet att FDA håller den utlovade tidsplanen och återkommer med sitt utlåtande inom 90 dagar, utan krav på ytterligare kompletteringar, skulle AcuCort potentiellt kunna lämna in en fullständig NDA-ansökan redan i slutet av Q1-25.
Detta skulle inte bara representera ett viktigt steg framåt i Bolagets regulatoriska process, utan även utgöra en betydande värdedrivare under år 2025. En inskickad NDA-ansökan stärker AcuCorts förhandlingsposition i dialoger med potentiella licenspartners, vilket gör att en återkoppling från FDA utgör en viktig trigger att bevaka under H1-25. Med den stundande företrädesemissionen, som vid full teckning kan tillföra Bolaget ca 48 MSEK, förväntas AcuCorts finansiella ställning stärkas avsevärt. Detta är av stor betydelse för att möta den ökade efterfrågan och säkerställa resurser för att finansiera partner- och licensförhandlingar, inklusive juridiska ombud, bl.a. med fokus på den lukrativa amerikanska marknaden.”
Kommentar på AcuCorts Q3-rapport samt företrädesemission
2024-12-02
AcuCort (”AcuCort” eller ”Bolaget”) har publicerat Bolagets delårsrapport för det tredje kvartalet 2024. Följande är några punkter som vi valt att belysa i samband med rapporten:
- Lansering av Zeqmelit® på nordiska apotek
- Emission om ca 48 MSEK – tillväxtkapital för fortsatt expansion
- VD och styrelseordförande avser teckna aktier utöver pro-rata andel – sänder starkt signalvärde
- Varumärkesskydd för Zeqmelit® har erhållits i USA
- Beviljas förlängd SME-status – medför lägre kostnader
- Samtliga patienter har genomgått AcuCorts Fas 4-studie (ZEQ001)
- Presenterat studieresultat på den vetenskapliga konferensen ISPOR
- Solid kostnadskontroll
- Kapitalanskaffningen skapar finansiellt spelrum för fortsatt tillväxt
Företrädesemission om ca 48 MSEK skapar utrymme för ytterligare expansion
Efter utgången av kvartalet meddelade AcuCort att styrelsen beslutat, villkorat av godkännande vid extra bolagsstämma den 19 december 2024, om en emission av units bestående av aktier och teckningsoptioner av serie TO 2 med företrädesrätt för AcuCorts aktieägare. Vid full teckning av företrädesemissionen tillförs Bolaget cirka 47,7 MSEK före emissionskostnader, och vid fullt utnyttjande av teckningsoptionerna förväntas Bolaget erhålla ytterligare ca 23,8 MSEK före emissionskostnader.
VD och styrelseordförande avser teckna aktier utöver pro-rata andel om sammanlagt ca 1,1 MSEK
Emissionen omfattas till ca 81 % av tecknings- (31 %) och garantiåtaganden (50 %), där styrelse, VD och större aktieägare har ingått teckningsåtaganden motsvarande deras pro-rata-andelar om upp till totalt ca 13,8 MSEK. Värt att belysa är att, utöver att teckna pro-rata andelen, har Bolagets VD, Jonas Jönmark, och styrelseordförande, Ebba Fåhraeus, meddelat att de avser att teckna units för ytterligare ca 0,9 MSEK respektive 0,2 MSEK, vilket gör att det sammantagna teckningsåtagandet från ledning och styrelse samt större aktieägare uppgår till ca 31 %. Detta sänder ett starkt signalvärde beträffande ledningen och styrelsens positiva framtidstro gällande Zeqmelit® fortsatta kliv mot ett kommersiellt genombrott.
Teckningsperioden i företrädesemissionen beräknas löpa under perioden 9 januari 2025 – 24 januari 2025, och teckningskursen uppgår till 0,5 kr per aktie. Teckningsoptionernas inlösenperiod sträcker sig mellan den 9 juni 2025 till och med den 20 juni 2025, och teckningskursen uppgår till 0,75 kr per aktie.
Bakgrunden till kapitalanskaffningen är ett ökat intresse för Zeqmelit från potentiella distributions- och licenspartners sedan produkten lanserades av Unimedic på de nordiska marknaderna under Q3-24, där AcuCort nu för dialoger och förhandlingar med flertalet partners avseende nyckelmarknader i EU och ROW (Rest of the World), med målsättning att i närtid presentera ett avtal avseende ett eller flera länder.
För att kunna exekvera på den ökade efterfrågan avser AcuCort nu att genomföra en emission för att kunna finansiera de nödvändiga tillväxtsatsningar som krävs för att ta ytterligare kliv mot ett globalt kommersiellt genombrott. Analyst Group bedömer kapitalanskaffningen som kritisk för att kunna ta tillvara på de betydande tillväxtmöjligheter och den ökande efterfrågan som råder, där denna emission förväntas skapa finansiellt spelrum att fullfölja de potentiella möjligheter som kan mynna ut i lukrativa licensavtal och starka kassaflöden framgent.

Zeqmelit® har lanserats på svenska, norska och finska apotek
Under kvartalet har lanseringen av Zeqmelit® påbörjats, med Sverige som första marknad, där munfilmerna blev tillgänglig på apotek den 2 september. Kort därefter, den 15 september, lanserades Zeqmelit® även på apotek i Norge och Finland. Distributionspartnern Unimedic Pharma, som ansvarar för försäljning och marknadsföring i Sverige, Norge, Finland och Danmark, besitter en stark meritlista inom läkemedelslanseringar och en bred kännedom avseende den nordiska och nordeuropeiska marknaden. Således bedömer Analyst Group att AcuCort, tillsammans med distributören Unimedic Pharma, har gynnsamma förutsättningar för att uppnå en framgångsrik kommersialisering på de nordiska huvudmarknaderna.
Erhållit varumärkesskydd för Zeqmelit® i USA
Under Q3-24 har Zeqmelit® registrerats som varumärke i USA, en strategiskt viktig milstolpe inför Bolagets kommande kommersialiseringsfas på den breda och viktiga amerikanska läkemedelsmarknaden. Varumärkesregistreringen, som utfärdats av den amerikanska myndigheten USPTO, gäller i 10 år och kan därefter förnyas. Analyst Group bedömer att varumärkesgodkännandet av Zeqmelit® är en betydande förutsättning för en framgångsrik kommersialisering i USA. Beträffande ett eventuellt marknadsgodkännande på den amerikanska marknaden pågår nu arbetet med att färdigställa Bolagets iPSP (initial Pediatric Study Plan), vilket är en förutsättning för att kunna skicka in ansökan till FDA. Denna ansökan förväntas skickas in under år 2025, vilket bedöms utgöra en trigger i relativ närtid. Ett eventuellt marknadsgodkännande och expansion på den amerikanska marknaden är av yttersta vikt, inte bara på grund av dess betydande försäljningspotential som världens största läkemedelsmarknad, utan även för att underlätta en framtida global expansion.
Beviljas förlängd SME-status
Efter kvartalets utgång meddelade AcuCort att Bolaget beviljats förlängd SME-statusen av EMA, vilket innebär att Bolaget behandlas som ett SME-bolag av myndigheten till och med den sista december år 2025. Detta innebär i sin tur att AcuCort undantas från avgifter, antingen helt eller delvis, i samband med regulatoriska ansökningar kopplade till försäljning och marknadsföring av läkemedel inom EU och EEA. Analyst Group ser detta som positivt, då det förväntas medföra reducerade avgifter vid marknadsregistreringar, och därigenom minska den operationella kapitalförbrukningen när Bolaget skalar upp marknadsföringsinsatserna inom EU och EEA framgent.
Samtliga patienter har genomgått AcuCorts Fas 4-studie (ZEQ001)
AcuCort meddelade, efter utgången av Q3-24, att samtliga patienter har genomgått Bolagets Fas 4-studie, ZEQ001, som inleddes under Q1-24. Studien omfattade totalt 50 patienter, och resultaten kommer att publiceras i vetenskapliga tidskrifter. Detta utgör ett viktigt stöd i AcuCorts lanseringsarbete framgent, då publiceringen av värdefulla insikter relaterade till patienternas erfarenheter och trygghet med läkemedlet är centrala marknadsföringsverktyg för att nå ut till astma- och allergiläkare. Som tidigare nämnts är den kliniska studien inte direkt nödvändig för kommersialiseringen av Zeqmelit®, utan fungerar primärt som ett värdefullt marknadsföringsunderlag.
Presenterat studieresultat på den vetenskapliga konferensen ISPOR i Barcelona
AcuCort har, efter kvartalets utgång, presenterat resultaten från studien ”Swedish Allergists’ View on the Role of Cortisone and the Formulation (Tablets or Self-Dissolving Film) for the Treatment of Acute Allergic Reactions” på den vetenskapliga konferensen ISPOR Europe i Barcelona. Studien, som genomfördes år 2023 genom intervjuer med kliniskt erfarna allergologer, syftar till att klargöra när och i vilken utsträckning kortison används i förhållande till allergins svårighetsgrad och vilka förutsättningar för behandling som råder i den akuta situationen för patienter som idag behandlas med kortisontabletter. Studieresultaten belyser centrala faktorer, såsom att allergologer uppfattar behandlingssituationen med traditionella kortisontabletter som suboptimal, då patienter ofta är ensamma, stressade, saknar medicin eller vatten. Vidare identifierade samtliga allergologer tydliga fördelar med Zeqmelit® jämfört med kortisontabletter, primärt då dess egenskaper underlättar administrering och förbättrar följsamhet. Analyst Group bedömer att ISPOR utgör ett viktigt forum för att nå Bolagets huvudsakliga målgrupp, astma- och allergiläkare, särskilt då läkares benägenhet att förskriva Zeqmelit® påverkar den framtida marknadsacceptansen och därmed försäljningen av läkemedlet.
Nettoomsättning och kostnadsbas
Nettoomsättningen uppgick till ca 0,7 MSEK (0) under Q3-24, hänförligt till den initiala utrullningen av Zeqmelit® på nordiska apotek. Bolaget betonar i rapporten att aktivitetsnivån är hög inom Sverige, Finland och Norge, där Bolaget har fört flertalet dialoger med viktiga aktörer inom området avseende framtidens allergibehandlingar och vilka luckor Zeqmelit® fyller med dess unika egenskaper. Framgent förväntas de nordiska hemmamarknaderna utgöra en språngbräda för den stundande internationella expansionen inom viktiga marknader såsom Frankrike, Tyskland, Storbritannien och USA, vilket möjliggörs genom den nyligen annonserade företrädesemissionen.
Under Q3-24 uppgick Bolagets totala rörelsekostnader till 4,0 MSEK (4,8), vilket motsvarar en minskning om ca 16 % i jämförelse med Q3-23 och en minskning om ca 21 % Q-Q, då rörelsekostnaderna uppgick till ca 5,1 MSEK. Sett till förändringen Y-Y och Q-Q är det primärt en reducering i övriga externa kostnader som bidrar till den minskade kostnadskostymen på rörelsenivå, där minskningen uppgår till ca 26 % Y-Y och ca 25 % Q-Q. Analyst Group bedömer att AcuCort uppvisar en solid kostnadskontroll under det tredje kvartalet, vilket illustreras av den reducerade kostnadsmassan både Y-Y och Q-Q.
Finansiell position
Vid utgången av september 2024 uppgick kassan till ca 8,0 MSEK, vilket motsvarar en minskning om ca 3,8 MSEK mot föregående kvartal då kassan uppgick till 11,7 MSEK. AcuCort har uppvisat en genomsnittlig operativ kapitalförbrukning om ca -1,0 MSEK/månad under Q3-24, och med kvartalets investeringar i beaktning uppgår det negativa fria kassaflödet (FCFF) till ca -1,3 MSEK/mån. I jämförelse med föregående kvartal (Q2-24) har kapitalförbrukningen således minskat drastiskt, då den operativa kapitalförbrukningen uppgick till -1,6 MSEK/månad, och -2,0 MSEK med hänsyn till investeringarna.
Givet kassan vid utgången av Q3-24 (8,0 MSEK) och den stundande företrädesemissionen, vilken initialt kan tillföra Bolaget ca 48 MSEK före emissionskostnader, bedömer Analyst Group att AcuCort har tillräckligt med tillväxtkapital för att exekvera på den ökande efterfrågan framgent. En säkrad finansiell ställning skapar flexibilitet och stärker Bolagets förhandlingsposition i dialoger med potentiella kommersiella partners. Vidare kan teckningsoptionerna (TO2) tillföra Bolaget ytterligare ca 23,8 MSEK före emissionskostnader under Q2-25, vilket förväntas stärka den finansiella ställningen ytterligare.
Sammantaget konstaterar Analyst Group att AcuCort står inför en expansiv fas, där företrädesemissionen om ca 48 MSEK förväntas utgör en central pelare för att möjliggöra Bolagets strategiska tillväxtsatsningar och internationella expansion. Med ytterligare kapitalet siktar Bolaget på att intensifiera dialogerna med potentiella licens- och distributionspartners på nyckelmarknader, såsom Frankrike, Tyskland, Storbritannien och USA, samtidigt som det möjliggör finansiering av regulatoriska processer och marknadsföringsinsatser för Zeqmelit®. Det starka teckningsåtagandet från ledning och styrelse, i synnerhet att VD och styrelseordförande avser teckna units för ytterligare ca 0,9 MSEK respektive 0,2 MSEK, utgör ett starkt signalvärde och vittnar om en tydlig framtidstro. Vidare skapar det tydliga incitament för att generera aktieägarvärde framgent.
Det tredje kvartalet har präglats av fortsatta milstolpar gällande kommersialiseringen av Zeqmelit®, där den främsta ljuspunkten utgörs av lanseringen i Sverige, Norge och Finland. Vidare utgör det erhållna varumärkesskyddet i USA, förlängd SME-statusen av EMA och medverkan på ISPOR i Barcelona viktiga händelser under kvartalet. Med ett tydligt fokus på expansion, stark finansiell grund och en produkt med unik marknadspotential står AcuCort väl rustat att kapitalisera på den ökande efterfrågan framgent.
Kommentar på AcuCorts medverkan på den vetenskapliga konferensen ISPOR i Barcelona
2024-11-26
AcuCort (”AcuCort” eller ”Bolaget”) meddelade den 26 november år 2024 att Bolaget nyligen har presenterat resultaten från studien med titeln ”Swedish Allergists’ View on the Role of Cortisone and the Formulation (Tablets or Self-Dissolving Film) for the Treatment of Acute Allergic Reactions” på den vetenskapliga konferensen ISPOR Europe i Barcelona.
AcuCort genomförde ovan nämnda studie under år 2023, genom intervjuer med kliniskt erfarna allergologer. Syftet var att klargöra när och i vilken utsträckning kortison används i förhållande till allergins svårighetsgrad och vilka förutsättningar för behandling som råder i den akuta situationen för patienter som idag behandlas med kortisontabletter. I samband med den årligt återkommande vetenskapliga konferensen ISPOR Europe (International Society for Pharmacoeconomics and Outcomes Research), som hölls den 17–20 november 2024, presenterade AcuCort resultaten från studien.
”Intresset för att ta del av studieresultaten var mycket stort bland såväl läkare och allergologer som från andra kommersiella aktörer. Vi hade bra och konstruktiva dialoger med potentiella kommersiella partners för de viktigaste europeiska länderna,” säger Jonas Jönmark, VD på AcuCort.
Sammanfattning av studieresultaten:
- Intervjuer med allergologer i Sverige lyfter fram den betydande rollen som kortikosteroider har vid behandling av svåra och akuta allergiska reaktioner.
- Faktorer som påverkar behandlingsresultat i verkliga situationer inkluderar patienters brist på tillgång till läkemedel, stress och förekomsten av ”icke-optimala behandlingssituationer”.
- Experterna är överens om att en självupplösande oral film har fördelar jämfört med tabletter, såsom förbättrad följsamhet och tillgänglighet, trots oro kring dess kostnad och dosering.
Ansvarig analytiker kommenterar
AcuCorts primära målgrupp består av astma- och allergiläkare, varför det är av betydande vikt att nå ut till läkarkåren gällande de patientfördelar som Zeqmelit® besitter, då läkares benägenhet att förskriva läkemedlet påverkar den framtida marknadsacceptansen och därmed försäljningen av Zeqmelit®. Analyst Group bedömer därför att den vetenskapliga konferensen ISPOR i Barcelona är ett utmärkt forum för att nå Bolagets huvudsakliga målgrupp och framhäva Zeqmelits® fördelar i jämförelse med traditionella behandlingsalternativ.
Studieresultaten belyser centrala faktorer, såsom att allergologer uppfattar behandlingssituationen med traditionella kortisontabletter som suboptimal, då patienter ofta är ensamma, stressade eller saknar medicin eller vatten. Samtliga allergologer identifierade tydliga fördelar med Zeqmelit® jämfört med kortisontabletter, särskilt tack vare dess egenskaper som underlättar administrering och förbättrar följsamhet.
Analyst Group anser att aktiviteter som detta utgör ett viktigt steg för att öka målgruppens förståelse för de betydande fördelar som Zeqmelit® erbjuder. Detta bedöms vara avgörande för att skapa en bredare acceptans inom läkarkåren och därmed förbättra försäljningsmöjligheterna framgent. Samtidigt bedömer Analyst Group att införsäljningsprocessen initialt kan vara utmanande, men att en ”ketchupeffekt” kan uppstå när astma- och allergiläkare får upp ögonen för läkemedlets fulla potential, vilket kan leda till en snabbare marknadsacceptans och ökad försäljning. AcuCort har för närvarande dialoger med potentiella kommersiella partners avseende de viktigaste marknaderna i Europa, vilket bådar gott inför den fortsatta utrullningen av Zeqmelit®.
Kommentar på att samtliga patienter har genomgått AcuCorts Fas 4-studie (ZEQ001)
2024-11-13
AcuCort (”AcuCort” eller ”Bolaget”) meddelade den 13 november år 2024 att samtliga patienter har genomgått Bolagets Fas 4-studie, ZEQ001, som inleddes under Q1-24. Studien omfattar 50 patienter och den sista patienten har nu genomfört studien. Studieresultaten kommer på sikt att publiceras i vetenskapliga tidskrifter och kommer därmed att utgöra ett viktigt stöd i AcuCorts lanseringsarbete.
”Vår Fas IV-studie ZEQ001 är en viktig milstolpe för AcuCort och för den vetenskapliga grunden för Zeqmelit®. Studien ger oss värdefulla insikter i patienternas erfarenheter och trygghet med läkemedlet. Vi ser fram emot att dela de vetenskapliga resultaten, och vi är övertygade om att de kommer att vara ett viktigt underlag för både hälso- och sjukvården samt för våra samarbetspartners i arbetet med att förbättra vården för patienter som lider av svår allergi,” säger AcuCorts VD Jonas Jönmark.
Ett huvudsyfte med denna öppna, icke-randomiserade låginterventionsstudie är att erhålla vetenskapliga data från patienter som tidigare använt tabletter men som i studien istället använder Zeqmelit®. Studien syftar till att besvara centrala frågor, såsom patienternas trygghetskänsla med Zeqmelit®, deras användarupplevelse av läkemedlet, samt i vilken utsträckning de bär det med sig i sin dagliga rutin.
Ansvarig analytiker kommenterar
”Det slutgiltiga genomförandet av Fas 4-studien utgör ett viktigt steg i rätt riktning, framför allt då publicering i vetenskapliga tidskrifter utgör ett viktigt forum för att nå ut till Bolagets målgrupp, nämligen astma- och allergiläkare, vilket är essentiellt för att främja en högre grad av marknadsacceptans framgent. Återigen är det värt att förtydliga att den kliniska studien som nu genomförts inte är direkt nödvändig för kommersialiseringen av Zeqmelit®, då produkten redan har erhållit marknadsgodkännande och befinner sig i en kommersialiseringsfas, med en pågående utrullning på nordiska apotek.”
Kommentar på att AcuCort beviljas förlängd SME-status av EMA, den nordiska lanseringen av Zeqmelit® samt den stundande medverkan på ISPOR i Barcelona
2024-10-02
AcuCort (”AcuCort” eller ”Bolaget”) meddelade den 2 oktober år 2024 att Bolaget har beviljats förlängd SME- (Small or Medium-sized Enterprise) status av den europeiska läkemedelsmyndigheten, European Medicines Agency (EMA). Vidare fortskrider lanseringen av Zeqmelit® enligt plan, och under september månad lanserades läkemedlet initialt på svenska apotek (2 sep), och från och med den 15 september finns även läkemedlet tillgängligt på apotek i Norge och Finland. Utöver detta har AcuCort meddelat att Bolaget avser presentera på den vetenskapliga konferensen ISPOR i Barcelona i november, vilket utgör en viktig möjlighet att nå ut till Bolagets primära målgrupp, nämligen astma- och allergiläkare.
Förlängd SME-status medför lägre kostnader
Den förlängda SME-statusen som beviljats av EMA innebär att Bolaget behandlas som ett SME-bolag av myndigheten till och med den sista december år 2025, vilket innebär att AcuCort undantas från avgifter, antingen helt eller delvis, i samband med regulatoriska ansökningar kopplade till försäljning och marknadsföring av läkemedel inom EU och EEA.
”Beskedet från EMA innebär att avgifterna vid marknadsregistreringar hålls så låga som möjligt och att vi kan ta vara på rådgivning och andra förmåner som erbjuds inom EU för små bolag,” säger Jonas Jönmark, VD på AcuCort.
Zeqmelit® har lanserats i Sverige, Norge och Finland
I linje med vad AcuCort tidigare kommunicerat har lanseringen av Zeqmelit® fortlöpt enligt plan, där den svenska hemmamarknaden var först ut, då Zeqmelit® lanserades på apotek i Sverige den 2 september. Knappt två veckor senare, den 15 september, var Norge och Finland på tur då Zeqmelit® lanserades på norska och finska apotek.
”Lanseringen av Zeqmelit® fortlöper enligt plan och vi har fått mycket positiv återkoppling från både läkare och patienter sedan läkemedlet lanserades på marknaden. Nu har ytterligare en viktig milstolpe uppnåtts i och med den internationella expansion som lanseringen i Norge och Finland innebär. Läkare kan nu i tre nordiska länder förskriva Zeqmelit® och allergipatienter kan därefter hämta ut produkten på apotek,” säger AcuCorts VD Jonas Jönmark.
Vetenskapliga konferensen ISPOR – Viktig marknadsföringskanal
Utöver ovan nämnda nyheter har även AcuCort meddelat att Bolaget avser medverkar på den vetenskapliga konferensen ISPOR i Barcelona den 19 november 2024. Under konferensen kommer AcuCort att presentera resultaten från studien med titeln ”Swedish Allergists’ View on the Role of Cortisone and the Formulation (Tablets or Self-Dissolving Film) for the Treatment of Acute Allergic Reactions” som genomfördes under år 2023. Enligt allergologerna i undersökningen används kortison främst vid svåra akuta symtom och som tilläggsbehandling vid anafylaxi. Fyra av fem allergologer bedömde behandlingssituationen som suboptimal, då patienter ofta är ensamma, stressade eller har glömt medicin eller vatten. Samtliga allergologer såg tydliga fördelar med Zeqmelit® jämfört med kortisontabletter, tack vare dess egenskaper som underlättar administrering och följsamhet.
Ansvarig analytiker kommenterar
”Att AcuCort erhållit förlängd SME-status av EMA är positivt, då det förväntas medföra reducerade avgifter vid marknadsregistreringar, och därigenom minska den operationella kapitalförbrukningen när Bolaget skalar upp marknadsföringsinsatserna inom EU och EEA framgent.
Beträffande lanseringen av Zeqmelit® är det positivt att lanseringen, som föranletts av ett gediget förarbete tillsammans med Unimedic Pharma, fortskrider enligt plan. Bolagets distributionspartner, som kommer att ansvara för försäljning och marknadsföring av Zeqmelit® i Sverige, Norge, Finland och Danmark, besitter ett gediget track record av lyckosamma läkemedelslanseringar och en god kännedom om den nordiska samt nordeuropeiska läkemedelsmarknaden. Dessa faktorer är vitala för att nå en hög penetrationsgrad inom Bolagets nordiska huvudmarknader, vilket bådar gott inför den pågående utrullningen av Zeqmelit® på nordiska apotek.
Det är av stor vikt att nå ut till läkarkåren (astma- och allergiläkare) avseende de betydande patientfördelar som Zeqmelit® besitter, då läkares vilja att förskriva läkemedlet har en påverkan på den framtida marknadsacceptansen och därigenom försäljningen av Zeqmelit®. Således anser Analyst Group att det är positivt att AcuCort kommer presentera studieresultaten på den vetenskapliga konferensen ISPOR i Barcelona, vilket är en god möjlighet att nå ut till Bolagets primära målgrupp, nämligen astma- och allergiläkare. Sammantaget har AcuCort nått flertalet viktiga milstolpar i och med den påbörjade utrullningen av Zeqmelit® i Norden, och tillsammans med en väletablerad partner i form av Unimedic Pharma, bedömer Analyst Group att Bolaget har goda förutsättningar för en lyckad lansering av Zeqmelit®.”
Kommentar på AcuCorts Q2-rapport
2024-08-23
AcuCort (”AcuCort” eller ”Bolaget”) har publicerat Bolagets delårsrapport för det andra kvartalet 2024. Följande är några punkter som vi valt att belysa i samband med rapporten:
- Försäljningsstart av Zeqmelit®
- Fas 4-studien är fullrekryterad
- Studier publicerade i vetenskapliga tidskrifter indikerar god betalningsvilja för Zeqmelit®
- Zeqmelit® har registrerats som varumärke i USA
- Ökade rörelsekostnader till följd av intensifierad prelanseringsfas
- Kassan har stärkts av optionsinlösen
Försäljningsstart av Zeqmelit® under september månad
AcuCort hade tidigare kommunicerat att Zeqmelit® skulle kunna lanseras under sommaren 2024, men meddelade efter kvartalets utgång att försäljningsstarten för Zeqmelit® skjuts upp till början av september. Förseningen beror på att en av de underleverantörer som Bolagets kontraktstillverkare anlitar har drabbats av en försening. Således har förseningen inget med produkten att göra utan handlar om den bipacksedel som följer med produktens förpackning, vilket är utom AcuCorts kontroll. Zeqmelit® planeras att bli tillgängligt på apotek i Sverige den 1 september 2024, med lansering i Norge och Finland som förväntas ske kort därefter.
Fas 4-studien är fullrekryterad och löper enligt plan
Under Q2-24 har arbetet med Fas 4-studien vid namn ZEQ001 utvecklats väl, där samtliga 50 patienter är rekryterade. Alla patienter har nu tilldelats munfilmen för användning när behov av behandling för akut allergisk reaktion uppstår och framgent kan studieresultatet användas i en ansökan om att ingå i förmånssystemet via TLV samt publiceras i vetenskapliga tidskrifter och förstärka marknadsföringen av produkten. Värt att förtydliga är att den kliniska studien inte är direkt nödvändig för kommersialiseringen av Zeqmelit®, då produkten redan erhållit marknadsgodkännande. Likväl anser Analyst Group att resultaten från studien har potential att fungera som ett viktigt marknadsföringsverktyg av produkten, vilket kan vara en vital pusselbit för att nå ut till potentiella kommersialiseringspartners framgent. Vidare skulle ett godkännande från TVL betraktande pris- och subventionsansökan accelerera kommersialiseringen på den nordiska marknaden, varför resultat från studien anses som en betydande trigger framgent, då positiva resultat från studien är nödvändiga för att myndigheten ska kunna fatta beslut gällande högkostnadsskyddet.
Studier publicerade i internationella vetenskapliga tidskrifter
År 2022 genomförde AcuCort en enkätstudie om hur allergipatienter värderar sin behandling. Resultaten från studiens första del publicerades under Q2-24 i peer-review tidskriften World Allergy Organization Journal, som vänder sig till allergiläkare, allergipatientföreningar och andra relevanta målgrupper. Studien inkluderade 426 respondenter och i studiens första del fastslogs att det finns ett stort och tydligt patientbehov av ett läkemedel som Zeqmelit®, då resultatet bl.a. visade att 72 % av patienterna skulle föredra en munfilm likt AcuCorts framför tablettbehandling vid en svår allergisk reaktion. Vidare svarade cirka en fjärdedel av respondenterna att de upplevt svårigheter att svälja sin allergimedicin när en svår allergisk reaktion brutit ut.
I studiens andra del har betalningsviljan bland patienterna analyserats och resultaten från den andra delen av studien har under Q2-24 publicerats i den vetenskapliga tidskriften Journal of Health Economics and Outcomes Research. I artikeln framkommer bl.a. att behandling med självupplösande munfilm har ett värde hos patienterna som överstiger traditionell tablettbehandling med 574 kr. AcuCorts planerade prisbild för Zeqmelit® uppgår till 300 kr för varje förpackning innehållande två munfilmer, oavsett styrka, och den starka betalningsvilja som råder bland potentiella kunder visar tydligt att de värdesätter smidigheten med Zeqmelit® högt.
Artiklarna bedöms öka kännedomen om patienters behov av en munfilm vid akuta allergiska reaktioner samt den höga betalningsvilja som existerar, vilket Analyst Group bedömer validerar den starka efterfrågan som råder för patienter som lider av akut allergi, vilket är av stor vikt för att attrahera potentiella kommersialiseringspartners.
Zeqmelit® har registrerats som varumärke i USA
Efter periodens utgång meddelade Bolaget att Zeqmelit® har registrerats som varumärke i USA. Varumärkesskyddet utgör en strategiskt viktig milstolpe inför Bolagets kommersialiseringsfas på den amerikanska marknaden. USA är dels världens största enskilda läkemedelsmarknad, dels AcuCorts viktigaste marknad. Varumärkesregistreringen har utfärdats av den amerikanska varumärkesmyndigheten USPTO och gäller under 10 år och kan därefter förnyas.
Analyst Group ser varumärkesgodkännandet av Zeqmelit® som ett betydande steg i rätt riktning och en viktig förutsättning för en lyckosam kommersialiseringsfas i USA. Ett potentiellt marknadsgodkännande och expansion på den amerikanska marknaden är av stor vikt, inte enbart på grund av att det är världens största läkemedelsmarknad och således besitter betydande försäljningspotential, utan även för att det i framtiden kan underlätta etablering på den globala marknaden. Givet att Bolaget erhåller positiva besked från FDA avseende de kompletterande uppgifterna som skickades in under Q1-24, kan en potentiell NDA-ansökan skickas in under H2-24, och vid ett eventuellt godkännande i slutet av år 2025 är en potentiell försäljningsstart under H2-26 möjlig.
Kostnadsbas och finansiell position
Under Q2-24 uppgick Bolagets totala rörelsekostnader till 5,1 MSEK (3,9), vilket motsvarar en ökning om ca 30 % i jämförelse med Q2-23 och en ökning om ca 7 % Q-Q, då rörelsekostnaderna uppgick till ca 4,7 MSEK. Sett till förändringen Y-Y är det primärt kostnadsposten ”övriga externa kostnader” som bidrar till den svällande kostnadsmassan, där ökningen uppgår till 38 % jämfört med det andra kvartalet år 2023. Analyst Group bedömer att de aktiviteter som genomförts för att accelerera kommersialiseringen av Zeqmelit® har medfört en högre kostnadsbas, bl.a. relaterade till regulatoriska konsulter samt Fas 4-studien som inleddes i början av Q1-24. Givet att Bolaget genomgått en intensiv prelanseringsfas är det således fullt rimligt att kostnadsmassan växer, och Analyst Group drar därför inga större växlar av kostnadsutvecklingen under kvartalet.
Vid utgången av juni 2024 uppgick kassan till 11,7 MSEK, vilket motsvarar en ökning om ca 6,1 MSEK mot föregående kvartal då kassan uppgick till 5,6 MSEK vid utgången av mars. Den ökade kassan är primärt hänförlig till optionsinlösen av serie TO 1, som tillförde Bolaget ca 12,1 MSEK. AcuCort har uppvisat en genomsnittlig operativ kapitalförbrukning om -1,6 MSEK/månad under Q2-24, och med kvartalets investeringar i beaktning uppgår det negativa fria kassaflödet (FCFF) till ca -2,0 MSEK/mån.
Effekterna av den nordiska lanseringen av Zeqmelit® på nettoomsättningen under kommande kvartal, och i förlängningen på det fria kassaflödet, återstår att se. Givet kassan vid utgången av juni (11,7 MSEK) och en antagen kapitalförbrukning i linje med Bolagets FCFF under Q2-24 (-2,0 MSEK/mån), skulle AcuCort vara finansierade tills slutet av Q4-24, allt annat lika. Analyst Group bedömer dock att lanseringen av Zeqmelit®, som planeras till september 2024 sannolikt kommer att bidra till att minska det negativa fria kassaflödet, varför den finansiella ställningen inte framstår som lika alarmerande vid en närmare analys. Analyst Group kan dock inte utesluta risken för att behov av ytterligare externt kapital kan uppstå framgent.
Sammantaget konstaterar Analyst Group att AcuCort fortsätter att ta operativa steg i rätt riktning. Fortsatta framsteg i Bolagets Fas 4-studie vilket i kombination med publicerade artiklar i vetenskapliga tidskrifter indikerar en hög efterfrågan och betalningsvilja för adekvata behandlingsmetoder mot akut allergi. Samtidigt är studien och de publicerade artiklarna viktiga marknadsföringsverktyg när Bolaget nu går in i en ännu mer intensiv kommersialiseringsfas. Med den stundande lanseringen av Zeqmelit® runt hörnet kommer Analyst Group att noggrant bevaka utvecklingen, både vad gäller försäljning och patientmottagande. Vidare utgör resultaten från Bolagets Fas 4-studie och de följande beskeden från TLV triggers att beakta i närtid.
Vi kommer att återkomma med en uppdaterad aktieanalys av AcuCort.
Kommentar på AcuCorts läkemedel Zeqmelit® som har registrerats som varumärke i USA
2024-08-08
AcuCort (”AcuCort” eller ”Bolaget”) meddelade den 8 augusti år 2024 att Bolagets läkemedel Zeqmelit® har registrerats som varumärke i USA.
Varumärkesskyddet utgör en strategiskt viktig milstolpe inför Bolagets kommersialiseringsfas på den amerikanska marknaden. USA är dels världens största enskilda läkemedelsmarknad, dels AcuCorts viktigaste marknad. Varumärkesregistreringen har utfärdats av den amerikanska varumärkesmyndigheten USPTO och gäller under 10 år och kan därefter förnyas.
”Det är mycket positivt att vi nu har fått varumärkesskydd för vår munfilm Zeqmelit® med tillhörande användningsområden i USA. Varumärkesskyddet är ett viktigt steg inför vår kommande kommersialiseringsfas i USA. Vidare ser vi fram emot att lansera Zeqmelit® i Norden från och med den 1 september”, säger AcuCorts VD Jonas Jönmark.
Zeqmelit® har registrerats som varumärke i EU:s samtliga medlemsstater samt Norge, Storbritannien, Schweiz, Australien, Indien, Israel, Kina, Japan och nu i USA.
Ansvarig analytiker kommenterar
”Parallellt med den stundande kommersialiseringen i Norden är det positivt att se att AcuCort gör strategiskt viktiga framsteg inför Bolagets kommersialiseringsfas på den amerikanska marknaden. Bakom kulisserna pågår en process avseende Bolagets marknadsgodkännande i USA, där AcuCort så sent som i februari 2024 lämnade in kompletterande uppgifter till FDA, och Bolaget inväntar nu besked för att kunna skicka in en formell New Drug Application (NDA). En NDA-ansökan enligt en så kallad 505(b)(2) process tar i regel ca 12 månader från dess att den skickas in, och processen kostar drygt USD 2m. Värt att förtydliga är dock att AcuCort fått en så kallad Small Business Waiver (SBW) godkänd, vilket innebär att Bolaget inte behöver betala något för NDA-ansökan.
Analyst Group ser varumärkesgodkännandet av Zeqmelit® som ett betydande steg i rätt riktning och en viktig förutsättning för en lyckosam kommersialiseringsfas i USA. Ett potentiellt marknadsgodkännande och expansion på den amerikanska marknaden är av stor vikt, inte enbart på grund av att det är världens största läkemedelsmarknad och således besitter betydande försäljningspotential, utan även för att det i framtiden kan underlätta etablering på den globala marknaden. Givet att Bolaget erhåller positiva besked från FDA avseende de kompletterande uppgifterna som skickades in under Q1-24, kan en potentiell NDA-ansökan skickas in under H2-24, och vid ett eventuellt godkännande i slutet av år 2025 är en potentiell försäljningsstart under H2-26 möjlig.”
Kommentar på AcuCorts Q1-rapport
2024-04-26
AcuCort (”AcuCort” eller ”Bolaget”) har publicerat Bolagets delårsrapport för det första kvartalet 2024. Följande är vår uppföljning av rapporten såväl som vår kommentar på de senaste operativa uppdateringarna.
Erhållit en första order – inleder kommersiell fas
Det inledande kvartalet av 2024 markerar en betydande milstolpe i AcuCorts historia, då Bolaget mottog sin första kommersiella order från distributionspartnern Unimedic Pharma, vilket således markerar transformationen från ett utvecklingsbolag till ett kommersiellt läkemedelsbolag. Bolaget bedömer att ordern, som avser Zeqmelit i dess tre styrkor, möter den initiala efterfrågan för den nordiska lanseringens första skede. AcuCort har säkrat produktionskapaciteten genom samarbetet med kontraktstillverkaren Adhex Pharma, och Zeqmelit förväntas vara tillgänglig på apotek i Norden från och med sommaren 2024. Ordervärdet uppgår till ca 0,8 MSEK och kommer att redovisas som en intäkt under Q2-24. Det är tydligt att Unimedic satsar på Zeqmelit med en sådan initial order och därtill mycket arbete och marknadsföring, vilket bådar gott inför lansering, då Unimedic Pharma är en etablerad aktör med lång erfarenhet inom distribution av läkemedel.
Stärkt varumärkesskyddet på strategiskt viktiga marknader
Som vi belyste i den senaste rapportkommentaren har Bolagets arbete med att stärka IP-portföljen fortlöpt, och under kvartalet har AcuCort erhållit varumärkesskydd för Zeqmelit i Schweiz och Indien. Även om Bolaget inom närtid förväntas rikta merparten av fokuset på lanseringen i Norden är beviljade varumärkesskydd viktiga förutsättningar för framtida kommersialisering på ytterligare marknader.
Fortsatta framsteg i fas 4-studien samt regulatoriska ansökningsprocesser
Under Q1-24, och även efter periodens utgång, har arbetet med fas 4-studien fortsatt enligt plan, där Bolaget meddelat att 40 av 50 patienter nu rekryterats. AcuCort har redan alla nödvändiga tillstånd på plats och har även genomfört samtliga kliniska studier, varför fas 4-studien nu genomförs i marknadsföringssyfte. Resultaten från studien ämnas publiceras i vetenskapliga tidskrifter, vilket Analyst Group bedömer kommer kunna utgöra ett viktigt marknadsföringsverktyg i diskussioner med potentiella kommersialiseringspartners framgent. De goda studieresultaten, i kombination med det tydliga patientbehovet, är viktiga pusselbitar i kommersialiseringen av läkemedlet, som Bolaget självt bedömer har potential att på sikt bli golden standard för behandling av patienter med svår allergi.
Under kvartalet har AcuCort lämnat in en uppdaterad pris- och subventionsansökan till TLV avseende Zeqmelit, vilket vid godkännande skulle innebära att läkemedlet kan säljas till slutkonsument inom det så kallade högkostnadsskyddet. Bolaget förväntar sig ett positivt besked från TLV under H1-24, vilket är en stark trigger i närtid. Utöver det stundande beskedet från TLV förväntar sig AcuCort att kunna lämna in en formell NDA-ansökan till FDA under H2-24, ett eventuellt godkännande tar i regel ca 12 månader.
AcuCorts kostnadsbas och finansiella position
Under Q1-24 uppgick Bolagets totala rörelsekostnader till 4,7 MSEK (4,4), vilket motsvarar en ökning om ca 8 % mot Q1-23 och i absoluta tal ca 0,4 MSEK, men jämfört med föregående kvartal (Q4-23), motsvarar första kvartalets utveckling en kostnadsreducering om nära 2 MSEK något Analyst Group ser positivt på. Efter utgången av kvartalet har AcuCort genom teckningsoptioner av serie TO 1 tillförts likvida medel om totalt ca 14,1 MSEK före emissionskostnader. Kapitaltillskottet från företrädesemissionen under fjärde kvartalet år 2023, tillsammans med optionsinlösen, har gjort det möjligt för Bolaget att öka marknadsinsatserna. Analyst Group bedömer att de aktiviteter som genomförts för att accelerera kommersialiseringen av Zeqmelit har medfört en högre kostnadsbas, bl.a. relaterade till regulatoriska konsulter samt fas 4-studien som inleddes i slutet av januari 2024. Ökade lanseringsinsatser till trots, bedömer Analyst Group att AcuCort uppvisar en solid kostnadskontroll, vilket kan ses i Bolagets rörelsekostnader, som är betydligt lägre än föregående kvartal och i linje med Q3-23.
Vid utgången av mars 2024 uppgick kassan till 5,6 MSEK, vilket motsvarar en minskning om ca -13,6 MSEK mot föregående kvartal, primärt hänförligt till en substantiell reducering av Bolagets rörelseskulder (-6,6 MSEK). Med hänsyn till kapitaltillskottet från optionsinlösen som ägde rum efter periodens utgång anser Analyst Group att den finansiella ställningen är solid. AcuCort har uppvisat en genomsnittlig kapitalförbrukning, s.k. burn rate, om -4,1 MSEK/månad under Q1-24, vilket som tidigare nämnts påverkats av återbetalning av rörelseskulder. Sett till den genomsnittliga kapitalförbrukningen LTM uppgår denna till ca -2 MSEK/månad, vilket Analyst Group bedömer är mer representativt för kapitalförbrukningen framgent. Med hänsyn till Bolagets rapporterade kassa vid utgången av mars, tillsammans med antagandet om en kapitalförbrukning i linje med LTM, samt kapitalinjektionen från optionsinlösen, skulle AcuCort vara finansierade under helåret 2024, allt annat lika.
Sammantaget konstaterar Analyst Group att AcuCort har uppnått betydande operativa framsteg sedan årsskiftet, särskilt genom den första kommersiella ordern som markerar AcuCorts övergång från ett forskningsbolag till ett kommersiellt läkemedelsbolag. Med fortsatta framsteg i rekryteringen av patienter till fas 4-studien, stundande besked från både TLV om prissubventionering och från FDA om NDA-ansökan, samt den förväntade utrullningen av Zeqmelit på nordiska apotek i sommar, bedömer Analyst Group att de kommande kvartalen blir mycket intressanta att följa.
Kommentar på AcuCorts Q4-rapport
2024-02-20
AcuCort (”AcuCort” eller ”Bolaget”) har publicerat bolagets delårsrapport för det fjärde kvartalet 2023. Följande är vår uppföljning av rapporten såväl som vår kommentar på de senaste operativa uppdateringarna.
Beviljas partihandelstillstånd av Läkemedelsverket och intensifierar marknadsinsatserna inför lansering…
I slutet av Q4-23 erhöll AcuCort partihandelstillstånd av Läkemedelsverket, vilket innebär att Bolagets kvalitetssystem uppfyller samtliga krav som myndigheter ställer vid handel med läkemedelsprodukter. Tillståndet är en viktig kvalitetsstämpel för Bolaget avseende kommersialiseringen av Zeqmelit® och AcuCort skriver i Q4-rapporten att den första kommersiella ordern bedöms komma från Unimedic Pharma under Q1-24. I och med detta har Bolaget även säkerställt produktionskapaciteten samt tagit fram en produktionsplan, i syfte att framgångsrikt kunna leverera på den förväntade efterfrågan vid lansering.
”I samband med att AcuCort blir ett säljande läkemedelsbolag motiverar detta enligt oss en högre värdering, något vi inte anser återspeglas i det rådande bolagsvärdet om 34 MSEK. Startskottet vid en första order kan således utgöra en trigger i aktien”, säger ansvarig analytiker på Analyst Group.
Inför kommande lanseringen har AcuCort ökat marknadsinsatserna, i syfte att öka kännedomen om Zeqmelit®, genom att bl.a. närvara på vetenskapliga möten för sjukvårdspersonal i Norden. Bolaget har även initierat en fas 4-patientstudie, vilken pågår parallellt med den nordiska marknadslanseringen, med syftet att förstärka marknadsföringen med praktisk erfarenhet från läkare och patienter. Målet med studien är att insamla värdefull data om användandet av Zeqmelit® från patienter som tidigare ordinerats kortikosteroider i tablettform för självbehandling vid akuta allergiska reaktioner. Studien rekryterar patienter löpande och ämnar omfatta ett 50-tal, där Bolaget strax innan Q4-rapporten meddelade att 10 patienter har rekryterats. Då AcuCort redan har alla tillstånd samt genomfört samtliga kliniska studier, är fas 4-studien inte nödvändig för själva lanseringen, utan genomförs endast i marknadsföringssyfte.
Vidare arbetar Bolaget fortsatt nära partnern Unimedic Pharma, vilka har över 50 års erfarenhet av marknadsintroduktioner av läkemedel, och Bolaget gör bedömningen att Zeqmelit® kommer att finnas tillgängligt på apotek i Norden under sommaren i år. Ett besked från Tandvårds- och läkemedelsförmånverket (TLV) gällande potentiell subvention av Zeqmelit® förväntas inkomma under H1-24, där ett potentiellt godkännande skulle bädda för en starkare försäljning i Sverige då slutkonsument omfattas av högkostnadsskyddet och möjliggörs därmed ett lägre pris.
…parallellt som Bolaget erhåller ytterligare varumärkesskydd och FDA-ansökan fortgår
Såväl under som efter kvartalet har AcuCort erhållit ytterligare varumärkesgodkännande för Zeqmelit® i följande länder: Kina, Norge, Japan, Indien och Schweiz. Bolaget har sedan tidigare erhållit varumärkesskydd för EU, Storbritannien, Australien och USA, vilka utgör viktiga pusselbitar för framtida kommersialisering i nämnda regioner då det ökar Bolagets ”vallgravar” mot konkurrenter. Samtidigt är det den nordiska kommersialiseringen som ligger närmast tillhands och är vital för att snabbt generera organiskt kassaflöde, vilket i sin tur skulle möjliggöra ett operativt momentum för att fortsätta investera för tillväxt genom egna medel.
Parallellt inväntar AcuCort svar från den amerikanska läkemedelsmyndigheten FDA avseende Bolagets förberedande dokumentation gällande marknadsgodkännande innan ansökan lämnas in. Ett marknadsgodkännande av Zeqmelit® för den amerikanska marknaden väntas erhållas mellan 2024 och 2025, där ett potentiellt godkännande skulle väsentligt stärka försäljningspotentialen då USA är världens största läkemedelsmarknad.
AcuCorts kostnadsbas och finansiella position
Under Q4-23 uppgick Bolagets totala rörelsekostnader till 6,7 MSEK (6,1), vilket motsvarar en ökning om ca 10 % mot Q4-22 och i absoluta tal om 0,6 MSEK. Jämfört med föregående kvartal i år (Q3-23), motsvarar fjärde kvartalets utveckling en kostnadsökning om nära 2 MSEK. Kapitalinjektionen i Q4-23 har möjliggjort ökade marknadsinsatser, där Analyst Group bedömer att förberedelsearbetet inför stundande kommersialisering har medfört ökade kostnader, i form av registrerings- och kommersialiseringsaktiviteter, såsom rekrytering och initiering av fas 4-studie. Även om kostnadsökningen är logisk, tillika förväntad, var kvartalets rörelsekostnader något över estimat.
Vid utgången av december 2023 uppgick kassan till 19,2 MSEK, vilket motsvarar en ökning om 12,2 MSEK mot föregående kvartal, primärt drivet av genomförd företrädesemission under kvartalet. Under 2023 har AcuCort uppvisat en genomsnittlig kapitalförbrukning, s.k. burn rate, om -1,5 MSEK/månad och under antagande att AcuCort utvecklas under en liknande kapitalförbrukning framgent, skulle AcuCort vara finansierade under hela år 2024, allt annat lika.
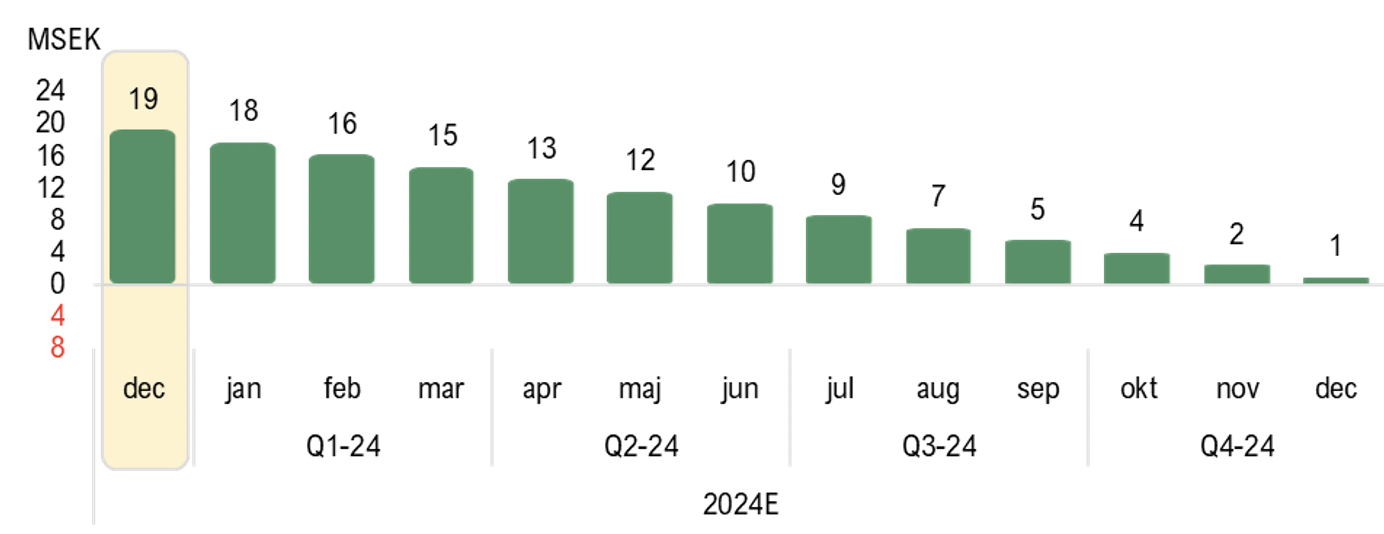
Däremot kan AcuCort komma att tillföras ytterligare 14 MSEK under mars 2024 via TO1, vilket därmed skulle förlänga kassalikviden ytterligare. I skrivande stund handlas AcuCorts aktie strax över 0,40 kr varför TO1 således i princip är in the money idag. Med hänsyn till detta anser vi att AcuCort i dagsläget har en mycket god finansiell position.
Avslutningsvis anser Analyst Group att AcuCort har tagit fortsatt viktiga operativa kliv framåt under det gångna kvartalet, men även under inledningen av 2024, dels genom erhållandet av partihandelstillståndet, dels genom initieringen av fas 4-studien. Med den första kommersiella ordern beräknad i Q1-24, nya varumärkesskydd säkrade, stundande besked från såväl TLV avseende prissubventionering som FDA avseende marknadsgodkännande, anser Analyst Group att 2024 blir ett högintressant år att följa och kommer markera AcuCorts övergång från ett forskningsbolag till ett kommersiellt läkemedelsbolag.
Med hänsyn till den presenterade Q4-rapporten kommer vi att återkomma med en uppdaterad aktieanalys av AcuCort.
Kommentar på AcuCorts Q3-rapport
2023-11-30
AcuCort har publicerat bolagets delårsrapport för det tredje kvartalet 2023. Följande är vår uppföljning av rapporten såväl som vår kommentar till den tidigare genomförda företrädesemissionen.
Påfylld kassa
AcuCorts tidigare företrädesemission avslutades för ungefär en månad sen, där bakgrunden till emissionen bl.a. var att accelerera kommersialisering av Zeqmelit®. Utifrån den kommunicerade teckningsgraden tillfördes AcuCort 21 MSEK före emissionskostnader som beräknas ha uppgått till högst 4,8 MSEK, beroende på ersättningsform till garanterna. Utifrån utfallet emitterades även ca 35 miljoner teckningsoptioner av serie TO1 vilka berättigar innehavaren till att teckna en (1) ny aktie i AcuCort för 0,40 kr under mars 2024. AcuCort kan således komma att tillföras ytterligare ca 14 MSEK om fyra månader. I skrivande stund handlas AcuCorts aktie omkring 0,40 kr varför TO1 således i princip är in the money idag. Det är dock som nämnt fyra månader kvar tills teckningsperioden och med hänsyn till de värdedrivare vi ser kan inträffa under denna tid så finns det utrymme för att AcuCorts aktie står i en högre kurs än vad den gör idag – vilket därmed kan ge en intressant affärsmöjlighet för optionsinnehavarna. AcuCort befinner sig bland annat i dialog med den amerikanska läkemedelsmyndigheten FDA om godkännande för Zeqmelit® i USA, vilket tillsammans med ytterligare kommersiella partners som bolaget avser att ingå avtal med skulle kunna accelerera kommersialiseringen av Zeqmelit® än mer. Den nuvarande kommersialiseringen, vilken initialt väntas ta plats i Norden, ses som essentiell för att generera ett snabbt positivt kassaflöde och således erhålla mer utrymme för satsningar inom tillväxt.
AcuCorts kostnadsbas och finansiella position
Under Q3-23 uppgick bolagets totala rörelsekostnader till 4,8 MSEK (4,6), vilket rent procentuellt är en ökning om endast 5 % mot Q3-22, och i termer av absoluta tal 0,2 MSEK. Jämfört med föregående kvartal i år (Q2-23), då AcuCorts totala rörelsekostnader uppgick till ca 3,9 MSEK, innebär det tredje kvartalets utveckling en kostnadsökning om 0,8 MSEK. Vi anser därmed att AcuCort fortsätter att uppvisa en god kostnadskontroll i rörelsen.
Vid utgången av september uppgick kassan till 7 MSEK och med hänsyn till den tillkommande nettolikviden från den efterföljande företrädesemissionen uppskattar vi att AcuCorts kassa vid utgången av oktober uppgick till omkring 23 MSEK. Under årets första nio månader har AcuCort uppvisat en genomsnittlig kapitalförbrukning, s.k. burn rate, om -1,1 MSEK/månad och givet ett antagande om en något högre kapitalförbrukning framgent om 1,5 MSEK/månad, skulle AcuCort vara finansierade tills slutet av år 2024, allt annat lika. Med det sagt kan dock AcuCort komma att tillföras ytterligare 14 MSEK under mars 2024 via TO1, vilket därmed skulle förlänga kassalikviden ytterligare. Med hänsyn till detta anser vi att AcuCort i dagsläget har en mycket god finansiell position.
Utöver ovan är det värt att upprepa att AcuCort under de senaste kvartalen har uppnått flera viktiga milstolpar i verksamheten; partneravtalet med Unimedic Pharma, varumärkesskydd i Kina såväl som i Norge, anslutning till Röda Webben, inledning av Fas IV-studien för Zeqmelit® såväl som pågående process med Läkemedelsverket om utfärdande av partihandelstillstånd. Under avslutningen av 2023 lägger AcuCort ett stort fokus kring FDA-processen och målet om att Zeqmelit® kommer att säljas på apotek i Sverige under 2024 kvarstår.
AcuCort har såldes, och fortsätter att, ta viktiga steg framåt. Med hänsyn till den presenterade Q3-rapporten kommer vi att återkomma med en uppdaterad aktieanalys av AcuCort.
Kommentar på AcuCorts delårsrapport Q2-23
2023-09-01
AcuCort publicerade den 31 augusti bolagets delårsrapport för det andra kvartalet år 2023.
Avtal med Unimedic Pharma för kommersialisering
Efter kvartalets utgång i augusti meddelade bolaget att ett partneravtal med Unimedic Pharma har tecknats för Sverige, Norge, Danmark och Finland. Till följd av avtalet med Unimedic Pharma, vilka kommer verka som kommersialiseringspartner för AcuCort, anses en kommersialisering av Zeqmelit, vilket skulle ta AcuCort till nästa fas i bolagets uppskalningsfas, ligga nära till hands. Unimedic Pharma är ett svenskt specialistläkemedelföretag med verksamhet i Norden och Europa, och anses besitta kompetensen samt de finansiella musklerna som krävs för att framgångsrikt ta Zeqmelit till marknaden. Som en effekt av att Zeqmelit har erhållit marknadsgodkännande i Sverige, Norge, Danmark och Finland sedan tidigare har nu AcuCort möjlighet att kapitalisera genom avtalet med Unimedic Pharma eftersom produkten potentiellt kan lanseras till marknaden inom de närmsta månaderna. Ett potentiellt besked om en subvention av Zeqmelit från svenska prismyndigheten TLV (Tandvårds- och läkemedelsförmånsverket) inväntas även för närvarande, vilket vid positivt besked förväntas möjliggöra att kommersialiseringen av Zeqmelit blir mer lukrativ för AcuCort, som en effekt av en mer fördelaktig prissättning mot kund.
Företrädesemission samt ytterligare kommersialiseringsplaner
För att accelerera kommersialisering av Zeqmelit meddelade AcuCort efter kvartalets utgång att bolaget tar in kapital via en företrädesemission som vid full teckning väntas tillföra bolaget ca 30 MSEK före emissionskostnader, samt att bolaget upptar ett brygglån om ca 5 MSEK för att förstärka likviditeten på kort sikt. Kapitalet från företrädesemission förväntas möjliggöra ytterligare satsningar inom organisationen, vilka är vitala för en framgångsrik kommersialisering. Samtidigt estimeras rörelsekapitalet som AcuCort förväntas erhålla vid en framgångsrik emission enligt bolaget vara tillräckligt för finansiering av verksamheten tills dess att AcuCort genererar återkommande intäkter till följd av en kommersialisering av Zeqmelit.
AcuCort befinner sig även i dialog med den amerikanska läkemedelsmyndigheten FDA om godkännande för Zeqmelit i USA, vilket tillsammans med ytterligare kommersiella partners som bolaget avser att ingå avtal med skulle generera en ännu storskaligare kommersialisering av Zeqmelit. Den nuvarande kommersialiseringen, vilken initialt väntas ta plats i Norden, ses däremot som essentiell för att generera ett snabbt positivt kassaflöde och således erhålla mer utrymme för satsningar inom tillväxt samt säkra likviditeten i närtid.
Erhåller etikgodkännande för studie avseende Zeqmelit
I juli erhöll AcuCort godkännande av Läkemedelsverket och Etikprövningsnämnden i Sverige att initiera studien ZEQ001. Syftet med ZEQ001-studien var att utvärdera Zeqmelit vid akut allergisk reaktion och är en del för den kommande kommersialiseringen i Norden. Studien, som är en fas IV-studie, har som övergripande mål att skaffa verklig erfarenhet, s.k. Real-World Evidence, av Zeqmelit från patienter som tidigare fått kortison förskrivet i tablettform för självbehandling vid akuta allergiska reaktioner. Vidare kommer studien ge information om tillgänglighet, trygghet med behandlingen och upplevd effekt hos patienterna. En initiering av studien estimeras ske under Q4-23 och pågå fram till Q2-24. En fas IV-studie skapar ytterligare möjligheter att insamla data om ett läkemedels säkerhet samt effekter i större skala efter marknadsgodkännande vilket Analyst Group ser som en väl vald strategi från AcuCorts sida för att kunna stärka Zeqmelits konkurrenskraft som inom kortisonmarknaden och det självklara valet för patienter med måttlig till svår allergi.
Har erhållit ytterligare varumärkesskydd
Under kvartalet erhöll även AcuCort varumärkesgodkännande för Zeqmelit i Storbritannien. Sedan tidigare har varumärkesskydd erhållits för EU och Analyst Group anser att skyddet som erhållits i Storbritannien skyddar bolagets intellektuella rättigheter på ytterligare en attraktiv marknad. Utöver Storbritannien har varumärkesskydd även erhållits i Australien, vilket höjer bolagets ”vallgravar” gentemot konkurrenter vid en kommersialisering inom denna marknad.
Beviljas patent för dexametason som munfilm i Brasilien
I maj meddelade AcuCort att bolaget har beviljats patent för dexametason som munfilm i Brasilien. Det beviljade patentet innebär att munfilmen erhåller nationellt skydd i Brasilien och upphör att gälla i november 2035. Enligt Worldometers uppgick Brasiliens befolkningsmängd till ca 215 miljoner år 2022, således ser Analyst Group en substantiell marknadspotential för Zeqmelit vid penetration av den brasilianska marknaden, vilket patenten potentiellt kan påskynda.
Sammanfattningsvis anser Analyst Group att avtalet med Unimedic Pharma ger AcuCort möjlighet att inleda en lukrativ kommersialisering av Zeqmelit i Norden, vilket bedöms som en attraktiv marknad, där produkten redan erhållit marknadsgodkännande. Avtalet verkar även som ett Proof of Concept för AcuCort som validerar bolagets hittills framgångsrika utveckling av Zeqmelit och väntas underlätta upprättandet av ytterligare kommersiella avtal för att ta Zeqmelit till fler internationella marknader.
Vi kommer att återkomma med en uppdaterad aktieanalys av AcuCort.
Kommentar på AcuCorts delårsrapport Q1-23
2023-04-28
AcuCort publicerade den 28 april bolagets delårsrapport för det första kvartalet år 2023.
Erhåller marknadsgodkännande i Finland
Under Q1-23 erhöll AcuCort marknadsgodkännande för bolagets läkemedel Zeqmelit i Finland av det finska ämbetsverket för läkemedelsövervakning, Fimea, därmed har Zeqmelit godkänts i de fyra största nordiska länderna. Med ytterligare ett marknadsgodkännande ser Analyst Group att det stärker AcuCorts position inför kommande dialoger med potentiella partners och regulatoriska myndigheter.
Lämnar in pris- och subventionsansökan till TLV avseende Zeqmelit
I januari lämnade AcuCort in en pris- och subventionsansökan till den svenska prismyndigheten Tandvårds- och läkemedelsförmånsverket (TLV) avseende bolagets läkemedel Zeqmelit®. Som tidigare kommunicerats har ansökan föregåtts av en enkätstudie som innefattade 426 allergipatienter. Studien gav ett positivt utfall där bland annat 72 % av patienterna svarade att de skulle föredra en munfilm framför tablettbehandling vid svår allergisk reaktion. Enkätstudien anses av AcuCort utgöra ett viktigt underlag för ansökan till TLV. Bolaget bedömer att slutgiltigt beslut om subventionerat pris kan erhållas under slutet av Q2-23, beroende på myndighetens tidsplan. Analyst Group ser ansökan som en viktig milstolpe och värdedrivare inför marknadsintroduktionen av Zeqmelit® i Sverige då läkemedelssubvention är essentiellt för att nå ut till en bredare marknad. Vidare bedömer Analyst Group sannolikheten att TLV ska godkänna AcuCorts pris- och subventionsansökan som mycket god.
Uppdatering kring dialog med FDA
AcuCort är för närvarande i dialog med amerikanska FDA där bolaget i februari 2023 meddelade att FDA har begärt kompletterande uppgifter inför en registreringsansökan. I och med att AcuCort har flera marknadsgodkännanden på utvalda marknader delar vi bolagets syn om att det inte skulle förändra ett positivt utfall av ansökan och är av uppfattningen att ett godkännande är sannolikt. AcuCort har i och med den förlängda handläggningstiden som kompletteringen innebär även fått datumet för sista inlämning under Small Business Waiver framskjutet. Därmed förlängs också tiden för befrielse från registreringsavgift om 1,6 MUSD, cirka 16,7 MSEK. Ett nytt sista datum för registreringsansökan under Small Business Waiver har ännu inte delgivits AcuCort, bolaget kommer således meddela marknaden så fort kompletterande uppgifter godkänts av FDA och ett nytt sista registreringsdatum har kommunicerats av myndigheten.
Utveckling av rörelsekostnader
De totala rörelsekostnaderna under Q1-23 uppgick till ca 4,4 (4,7) MSEK, motsvarande en minskning med 6 % Y-Y mot Q1-22. Jämfört med Q4-22, där de totala rörelsekostnaderna uppgick till ca 5 MSEK minskade de totala rörelsekostnaderna med ca 29 % under Q1-23. Minskningen i de totala rörelsekostnaderna kan hänföras till effektivare drifts- och utvecklingskostnader vilket resulterat i lägre övriga externa kostnader. De största kostnaderna utöver AcuCorts drift, är hänförliga till utvecklingsarbeten kring produktion och processer för kommersialisering, samt för regulatoriska konsulter.
Finansiell ställning och kapitalförbrukning
Vid utgången av Q1-23 uppgick AcuCorts kassa till ca 10,1 MSEK, vilket kan jämföras med ca 17,2 MSEK vid utgången av december Q4-22, motsvarande en nettoförändring om ca -7,1 MSEK. Bolagets burn rate per månad under Q1-23, då vi tar hänsyn till kassaflödet från den löpande verksamheten samt investeringar, uppgick till ca -2,4 MSEK under perioden, vilket överstiger rullande tolv månaders burn rate om ca -1,7 MSEK. Den högre burn raten per månad är hänförlig dels till en negativ förändring av rörelsefordringar om 1,1 MSEK, dels till en negativ förändring av rörelseskulder om 1,6 MSEK, vilket resulterar i en total negativ förändring av rörelsekapitalet om 2,7 MSEK. Den negativa förändringen av rörelsekapitalet är den största uppmätta under de åtta senaste kvartalen. Justerat för dessa poster hade burn raten per månad för kvartalet uppgått till ca -1,5 MSEK. Med hänsyn till nuvarande kassa om 10,1 MSEK och ett antagande om en konservativ genomsnittlig burn rate om ca -1,7 MSEK per månad framgent, estimeras AcuCort vara finansierade fram tills början av Q4-23, allt annat lika. Detta innebär att en potentiell kapitalanskaffning inte kan uteslutas med säkerhet under de kommande 12 månaderna. Det bör dock tilläggas att om bolaget lyckas realisera licensintäkter under perioden och bibehålla kostnadsfokus, kan det bidra till att bolaget är finansierade längre än estimerat.
Sammanfattningsvis ser Analyst Group att AcuCort utvecklas väl rent operativt för att nå bolagets övergripande mål att kommersialisera Zeqmelit globalt, där marknadsgodkännande i Norden utgör en språngbräda för ytterligare godkännanden. Vi upprepar således triggers såsom ett potentiellt godkännande för pris- och subventionsansökan hos TLV, nyheter från partnerdialoger likt avtalet som slöts med Kamada Ltd under Q4-22, samt nyheter från registreringsansökan i USA.
Vi kommer att återkomma med en uppdaterad aktieanalys av AcuCort.
Kommentar på AcuCorts delårsrapport Q4-22
2023-02-24
AcuCort publicerade den 24 februari bolagets delårsrapport för det fjärde kvartalet år 2022.
AcuCort tecknar sitt första kommersiella avtal för Zeqmelit
AcuCort meddelade under Q4-22 att bolaget har tecknat ett exklusivt kommersiellt avtal med det globala biofarmabolaget Kamada Ltd avseende den israeliska marknaden. Avtalet ger Kamada exklusiv rättighet till att marknadsföra, sälja, och distribuera AcuCorts läkemedel Zeqmelit för bland annat behandling av akut allergi på den israeliska marknaden. Kamada Ltd. är ett ledande globalt biofarmabolag med en väletablerad infrastruktur för marknadsföring, försäljning och distribution av kommersiella läkemedelsprodukter i mer än 30 länder. Bolaget är välrenommerat och har en stark position på sin hemmamarknad i Israel där Kamada idag distribuerar mer än 20 läkemedelsprodukter. Kamadas omsättning uppgår till över 100 MUSD årligen.
Enligt avtalet ansvarar Kamada för kommersialiseringen av Zeqmelit i Israel och har exklusiv rättighet till marknadsföring, försäljning och distribution av läkemedlet på denna marknad. Således åligger det Kamada att registrera Zeqmelit i Israel. Kamadas bedömning är att kunna lämna in en ansökan om registrering och marknadsgodkännande till den israeliska myndigheten (Ministry of Health, MOH) under det första kvartalet 2023. Handläggningen av ansökan förväntas ta mellan 8–24 månader.
Israels befolkning uppgår per dags dato till ca 9 miljoner enligt Worldometers. Som ett illustrativt exempel estimerar Analyst Group den totala bruttointäktspotentialen för Zeqmelit till ca 7,2 MUSD årligen, givet ett antagande om att ca 20 % av befolkningen lider av allergi1, en marknadspenetration om 10 %, och att läkemedlet förskrivs fyra gånger per år per patient till ett genomsnittligt pris om 10 USD/dos.
Lämnar in pris- och subventionsansökan till TLV avseende Zeqmelit
I januari 2023 efter utgången av Q4-22 lämnade AcuCort in en pris- och subventionsansökan till den svenska prismyndigheten Tandvårds- och läkemedelsförmånsverket (TLV) avseende bolagets läkemedel Zeqmelit®. Som tidigare kommunicerats har ansökan föregåtts av en enkätstudie som innefattade 426 allergipatienter. Studien gav ett positivt utfall där bland annat 72 % av patienterna svarade att de skulle föredra en munfilm framför tablettbehandling vid svår allergisk reaktion. Enkätstudien anses av AcuCort utgöra ett viktigt underlag för ansökan till TLV. Bolaget bedömer att slutgiltigt beslut om subventionerat pris kan erhållas under slutet av Q2-23, beroende på myndighetens tidsplan. Analyst Group ser ansökan som en viktig milstolpe och värdedrivare inför marknadsintroduktionen av Zeqmelit® i Sverige då läkemedelssubvention är essentiellt för att läkare ska kunna rekommendera läkemedlet till patienter samt nå ut till en bredare marknad, vilket även bekräftas av bolaget. Vidare bedömer Analyst Group sannolikheten att TLV ska godkänna AcuCorts pris- och subventionsansökan som mycket god.
Erhåller marknadsgodkännande i Finland
Efter utgången av Q4-22 erhöll AcuCort marknadsgodkännande för bolagets läkemedel Zeqmelit i Finland av det finska ämbetsverket för läkemedelsövervakning, Fimea. Därmed har Zeqmelit godkänts i samtliga nordiska länder. Med ytterligare ett marknadsgodkännande stärker det AcuCorts position inför kommande dialoger med potentiella partners och regulatoriska myndigheter.
Uppdatering kring dialog med FDA
AcuCort är för närvarande i dialog med amerikanska FDA där bolaget i februari 2023 meddelade att FDA har begärt kompletterande uppgifter inför en registreringsansökan. I och med att AcuCort har flera marknadsgodkännanden på utvalda marknader delar vi bolagets syn om att det inte skulle förändra ett positivt utfall av ansökan och är av uppfattningen att ett godkännande är sannolikt. AcuCort har i och med den förlängda handläggningstiden som kompletteringen innebär även fått datumet för sista inlämning under Small Business Waiver framskjutet. Därmed förlängs också tiden för befrielse från registreringsavgift om 1,6 MUSD, cirka 16,7 MSEK. Ett nytt sista datum för registreringsansökan under Small Business Waiver har ännu inte delgivits AcuCort, bolaget kommer således meddela marknaden så fort kompletterande uppgifter godkänts av FDA och ett nytt sista registreringsdatum har kommunicerats av myndigheten.
Nuvarande kassa och burn rate
Vid utgången av Q4-22 uppgick AcuCorts kassa till ca 17,2 MSEK, vilket kan jämföras med ca 21,3 MSEK vid utgången av september Q3-22, motsvarande en nettoförändring om ca -4,1 MSEK. Bolagets burn rate per månad under kvartalet uppgick således till ca -1,4 MSEK under perioden, vilket är något under rullande tolv månaders burn rate om ca -1,6 MSEK. Analyst Group anser att bolagets kassa är fortsatt stark samtidigt som kostnaderna hålls stabila inför den stundande kommersialiseringen. AcuCorts huvudsakliga utgifter kan hänföras till den operativa verksamheten, process- och produktionsutveckling samt regulatorisk konsultation. Med hänsyn till nuvarande finansiella position och ett antagande om en genomsnittlig burn rate om ca -1,6 MSEK per månad framgent, till följd av fortsatt god kostnadskontroll, estimeras AcuCort vara finansierade tills slutet av Q4-22, allt annat lika. Det bör även tilläggas att om bolaget lyckas realisera licensintäkter under perioden och bibehålla kostnadsfokus, kommer det att bidra till en lägre burn rate, där rörelsekapitalet förväntas räcka längre än estimerat. Bolaget bedömer att rörelsekapitalbehovet under kommande tolvmånadersperiod kommer tillgodoses med hjälp av tillgängliga likvida medel.
Sammanfattningsvis ser Analyst Group att AcuCort går från klarhet till klarhet genom att fortsätta leverera på bolagets kommersiella milstolpar, inte minst då ett första kommersiellt avtal tecknats med Kamada, vilket medför en validering av det kommersiella värdet för Zeqmelit och antas underlätta för AcuCort att sluta avtal med nya partners framgent. Vi upprepar således att vi ser triggers såsom ett potentiellt godkännande för pris- och subventionsansökan hos TLV, nyheter från partnerdialoger, samt nyheter från registreringsansökan i USA. Med hänsyn till hur likartade läkemedelsbolag som befinner i övergången till kommersiell fas värderas, ser vi att det finns en fortsatt uppsida och god risk/reward i AcuCort.
Vi kommer att återkomma med en uppdaterad aktieanalys av AcuCort.
- Hoyte FCL, Nelson HS. Recent Advances in Allergic Rhinitis. F1000Res. 2018 Aug 23;7: F1000 Faculty Rev-1333.
Kommentar på AcuCorts godkännande i Norge och positiva enkätstudieresultat
2022-09-28
AcuCort tillkännagav den 28:e september att bolaget har erhållit godkännande av den norska läkemedelsmyndigheten Statens Legemiddelsverk för bolagets läkemedel under namnet Zeqmelit, samt att bolaget fått positiva resultat från den enkätstudie om allergibehandling som genomförts, vilket kommer att ingå som underlag till subventionsansökan.
Tidigare i år har AcuCort erhållit godkännande i Danmark, där ett ytterligare godkännande i Norge är resultatet av en tydlig regulatorisk strategi som börjar visa effekt. Analyst Group ser detta som ett stärkande besked för AcuCort och en ökad sannolikhet att bolagets läkemedelskandidat kan börja inbringa försäljning under år 2023, vilket är enligt våra estimat. Framgent förväntas även ett godkännande från Finland erhållas, samtidigt är bolaget även igång med registreringsansökningar för andra prioriterade marknader inom EU, USA samt övriga nyckelmarknader.
”Vi är glada över att AcuCort har passerat ytterligare en viktig milstolpe då Zeqmelit nu är godkänt i Norge. Att bolagets första innovativa läkemedel är godkänt i hela Skandinavien skapar goda förutsättningar för en positiv utveckling av bolaget. Jag är optimistisk inför den kommande kommersialiseringen och vår fortsatta tillväxtresa”, säger Jonas Jönmark, VD för AcuCort, gällande godkännandet i Norge.
Gällande enkätstudien omfattades total 426 patienter som fick svara på frågor om sin allergi och om hur de värderar de tillgängliga behandlingsalternativen. Till en början skulle drygt 100 patienter inkluderats i studien, men det stora intresset för att delta och engagemanget bland allergikerna ledde till att studien utökades och slutligen inkluderades 426 respondenter. Resultaten från den nu avslutade enkätstudien är en viktig del i AcuCorts pris- och subventionsansökan för ISICORT till den svenska prismyndigheten TLV. De andra två delarna är dels en litteraturstudie, dels en panel av ledande experter. 72 % av patienterna svarade att de skulle föredra en munfilm framför tablettbehandling vid en svår allergisk reaktion, samt att 24 % upplevt svårigheter att svälja sin allergimedicin när de hade en svår allergisk reaktion, vilket Analyst Group ser som ett tydligt tecken på att behovet för AcuCorts produkt är mycket stark och har en tydlig positionering inom allergibehandlingsmarkaden.
”Vi är glada över de positiva resultaten från vår enkätstudie om allergibehandling. Vi hoppas på ett positivt besked av vår kommande ansökan till prismyndigheten TLV om subventionerat pris för ISICORT®, då läkemedlet erbjuder en helt ny och unik administrationsform som underlättar behandlingen för patienten vid en akut och svår allergisk reaktion. Ett positivt utfall kan dessutom bidra till en bättre förhandlingsposition i våra pågående diskussioner med potentiella licenstagare och distributörer”, säger Jonas Jönmark, VD för AcuCort, gällande enkätstudien.
Sammanfattningsvis så fortsätter AcuCort leverera på bolagets regulatoriska strategi samtidigt som enkätstudien visar indikationer på att det finns ett tydligt behov för ISICORT/Zeqmelit, där Analyst Group ser att bolaget tar sig allt närmare kommersialiseringsfasen och kan börja generera intäkter under år 2023.
Kommentar på AcuCorts Q2-rapport
2022-08-15
AcuCort publicerade den 12:e augusti sin delårsrapport för andra kvartalet 2022.
Följande är några punkter som vi valt att titta närmare på:
Godkänd ansökan om etikprövning för enkätstudie om allergibehandling
AcuCort meddelade tidigare under kvartalet att den ansökan om etikprövning avseende en patientenkätstudie där syftet är att dokumentera hur allergipatienter värderar sin behandling fick ett godkännande. Som tidigare nämnt är enkätstudien en viktig pusselbit då den kommer utgöra underlag för en framtida pris- och subventionsansökan till den svenska myndigheten Tandvårds- och Läkemedelsförmånsverket (TLV) tillsammans med två andra komponenter (litteraturstudie och genomgång av expertpanel). I och med att etikprövningen blev godkänd ser vi att AcuCort fortsätter ta steg i rätt riktning mot marknaden, och en ansökan om läkemedelssubvention till Tandvårds- och Läkemedelsförmånsverket (TLV) under H2-22 ser allt troligare ut.
Europeiska läkemedelsmyndigheten beviljar AcuCort SME-status vilket innebär monetära fördelar
Den europeiska läkemedelsmyndigheten (EMA) har beviljat AcuCort med Small- or Medium-sized Enterprise (SME)-status, vilket innebär ekonomiska fördelar vid ansökning om marknadsgodkännande inom EU, t ex sänkta ansökningsavgifter. SME-statusen är tidsbegränsad och gäller till och med den 31 december 2023. SME-statusen kan jämföras med den så kallade Small Business Waiver som AcuCort erhöll för registreringsprocessen av ISICORT® i USA där en besparing om ca 15 MSEK medföljde. AcuCort angav dock inga siffror om hur stor besparingen kan tänkas bli tack vare SME-statusen gällande den europeiska marknaden. Tittar man dock på EMA:s prislista kan det röra sig om besparingar kring
90–100 % där avgiften gällande ansökan om marknadsgodkännande för humanläkemedel börjar från 297 tEUR, motsvarande ca 3 MSEK, och där andra avgifter kan tillkomma1.
Finansiell position och burn rate
Vid utgången av Q2-22 uppgick AcuCorts kassa till ca 25,2 MSEK, vilket kan jämföras med ca 29,9 MSEK vid utgången av mars (Q1-22), motsvarande ett totalt nettokassaflöde om ca – 4,7 MSEK. Bolagets totala burn rate under kvartalet uppgick således till ca -1,6 MSEK per månad. Vi ser att bolaget är fortsatt välkapitaliserat samtidigt som kostnaderna hålls stabila inför den stundande kommersialiseringen. De huvudsakliga utgifterna under kvartalet enligt rapporten kan, likt tidigare kvartal, hänföras till driften men, även till process- och produktionsutveckling samt regulatorisk konsultation. Med nuvarande finansiell position och ett antagande om en genomsnittlig burn rate om ca -1,5 MSEK per månad framgent, vilket skulle vara i linje med genomsnittet på tolv månaders rullande basis, skulle det innebära att AcuCort är finansierade tills H2-23, allt annat lika.
Sammanfattningsvis ser vi att AcuCort utvecklas enligt plan och upprepar triggers såsom: resultat från enkäts- och litteraturstudien, ansökan och svar om pris- och subventionsansökan hos TLV, nyheter om nya distributör- eller licensavtal, samt nyheter från registreringsprocessen gällande den nordiska marknaden (Danmark, Finland, Island och Norge), den amerikanska marknaden eller andra utvalda marknader.
Vi kommer att återkomma med en uppdaterad aktieanalys av AcuCort.
Referenser:
Kommentar på AcuCorts Q1-rapport
2022-05-02
AcuCort publicerade den 28 april sin första kvartalsrapport för år 2022. Följande är några punkter som vi valt att titta närmare på i samband med rapporten:
- Finansiell position och burn rate
- FDA meddelar att ingen ansökningsavgift krävs från AcuCort
- Inlämnad etikprövning avseende enkätstudie för allergibehandling efter rapportperioden
Finansiell position och burn rate
Vid utgången av Q1-22 uppgick AcuCorts kassa till ca 29,9 MSEK, vilket kan jämföras med ca 35,9 MSEK vid utgången av december (Q4-21), motsvarande en förändring om ca -6 MSEK. Bolagets burn rate uppgick till ca -2,0 MSEK per månad, vilket är något mer än vad vi estimerat (-1,5 MSEK per månad). Dock ser vi att bolaget fortfarande är välkapitaliserat i och med den nyemission som gjordes Q4-21. De huvudsakliga utgifterna under kvartalet enligt rapporten kan hänföras till driften men, även till process- och produktionsutveckling samt regulatorisk konsultation. Med nuvarande finansiell position och ett antagande om en genomsnittlig burn rate om ca -1,4 MSEK per månad baserat på de fyra senaste kvartalen, skulle det innebära att AcuCort är finansierade tills Q4-23.
FDA meddelar att ingen ansökningsavgift krävs från AcuCort
AcuCort meddelade tidigare i år att den amerikanska läkemedelsmyndigheten FDA beviljade bolaget befrielse från ansökningsavgiften för registreringsprocessen av ISICORT® i USA via en så kallad Small Business Waiver vilket innebär en besparing om 1,6 MUSD, motsvarande 15,4 MSEK, med villkor om att bolaget lämnar in ansökan för registrering senast den 28:e februari 2023. Analyst Group ser detta som ett positivt besked då finansiering som skulle använts till mer omfattande regulatoriska processer istället kan gå ansökan på andra marknader och diverse marknadsinsatser vilket kan öka sannolikheten för en lyckad kommersialisering framgent, givet att godkännande erhålls på respektive målmarknader.
Inlämnad etikprövning avseende enkätstudie för allergibehandling efter rapportperioden
Den 26:e april tillkännagavs att AcuCort lämnat in en ansökan om etikprövning avseende en patientenkätstudie där syftet är att dokumentera hur allergipatienter värderar sin behandling. Enkätstudien estimeras omfatta ca 100 patienter som skall svara på frågor om sin allergi och om hur de värderar andra tillgängliga behandlingsalternativ. Enkätstudien är en viktig pusselbit då den kommer utgöra underlag för en framtida pris- och subventionsansökan till den svenska myndigheten Tandvårds- och Läkemedelsförmånsverket (TLV). Ett positivt utfall kan även ge en fördel vid diskussioner med potentiella licenstagare. Vi ser detta som en väl vald strategi från AcuCorts sida då en subventionerad läkemedelsprodukt blir mer värdefull eftersom den minskar risken att patienter potentiellt skulle sakna betalningsförmåga för läkemedlet i och med att det delvis- eller fullständigt bekostas med hjälp av statliga medel. Vi estimerar att AcuCort ansöker till TLV under H2-22, givet att Etikprövningsmyndigheten godkänner etikprövningen.
Sammanfattningsvis ser vi att AcuCort utvecklas enligt plan och vad som kan ligga i korten framöver bland annat inkluderar godkännande av etikprövningen från Etikprövningsmyndigheten, ansökan om pris- och subventionsansökan hos TLV samt nyheter från registreringsprocessen gällande den nordiska marknaden (Danmark, Finland, Island och Norge).
Vi kommer att återkomma med en uppdaterad aktieanalys av AcuCort.
Kommentar på AcuCorts Q4-rapport
2022-02-28
AcuCort publicerade den 24 februari sin bokslutskommuniké för år 2021 samt delårsrapport för Q4-21. Följande är några punkter som vi valt att titta närmare på i samband med rapporten:
- Nuvarande kassa och kapitalförbrukning
- Nytt avtal med kontraktstillverkaren Adhex Pharma
- Kommersialisering i fortsatt fokus
Nuvarande kassa och kapitalförbrukning
Vid utgången av Q4-21 uppgick kassan till ca 35,9 MSEK, vilket kan jämföras med ca 14,4 MSEK vid utgången av september (Q3-21). Kassaökningen kan härledas till den företrädesemission samt riktade emission som gjordes tidigare under 2021. För helåret uppgick Bolagets burn rate, till -1,1 MSEK per månad, vilket vi anser tyder på god kostnadskontroll. Precis som vi har kommunicerat tidigare har vi i våra modeller räknat med att AcuCort under kommande kvartal kommer att ha en något högre kapitalförbrukning. Det i sig är helt naturligt med tanke på den kommande kommersialiseringen av ISICORT. Med kassan per den sista december, samt kapitaltillskottet från emissionerna, har AcuCort en stark finansiell position. En stark kassaposition för ett mindre läkemedelsbolag likt AcuCort är mycket fördelaktigt i samband med till exempel att diskussioner förs med potentiella licenstagare, detta då det skapar en större handlingsfrihet och medför att AcuCort kan agera mindre ”stressat” i förhandlingar, vilket i slutändan kan vara helt avgörande för att ett fördelaktigt avtal ska kunna komma på plats. Med nuvarande finansiell position och ett antagande om en genomsnittlig burn rate om -1,5 MSEK/månad, skulle det innebära att AcuCort är finansierade tills slutet av 2023.
Nytt avtal med kontraktstillverkaren Adhex Pharma
Under februari 2022 meddelade AcuCort att ett nytt avtal tecknats med den franska kontraktstillverkaren Adhex Pharma avseende kommersiell produktion av ISICORT i storskalig volym enligt god tillverkningssed (Good Manufacturing Practice, GMP). Detta är en viktig milstolpe för AcuCort då det säkerställer produktförsörjningen av ISICORT inför kommersialiseringen och minskar således den operationella risken. Vi ser detta som ett robust samarbete med en lämplig partner då Adhex Pharma är nischade inom framställning av medicinska plåster och tunna munfilmer vilket passar ISICORTs produktprofil.
Kommersialisering i fortsatt fokus
AcuCort har sedan tidigare godkännande av ISICORT i Sverige och offentliggjorde i november 2021 att en registreringsprocess är igång via den så kallade proceduren för ömsesidigt erkännande (Mutual Recognition Procedure, MRP) med fokus på Danmark, Finland, Island och Norge. Mer konkret innebär detta att bolaget kan ansöka om vidare godkännande inom EU genom att använda sitt svenska godkännande som underlag. Bolaget förväntar sig ett svar från regulatoriska myndigheter under H1-22 gällande MRP-processen. Vidare så för AcuCort även en aktiv dialog med den amerikanska läkemedels-myndigheten för att kunna påbörja processen för godkännande i USA. Utfallen kring dessa dialoger ser vi skulle kunna utgöra en stark värdedrivare i aktien.
Vi kommer att återkomma med en uppdaterad aktieanalys av AcuCort.
Kommentar på AcuCorts Q3-rapport
2021-11-15
AcuCort publicerade den 12 november 2021 sin delårsrapport för tredje kvartalet 2021. Följande är vår uppföljning av rapporten och vad vi främst fokuserat på.
- Tillgänglig likviditet och kapitalförbrukning
- Påfylld kassa via emissioner
- Fokus framåt
Vid utgången av tredje kvartalet uppgick kassan till ca 14,4 MSEK, vilket kan jämföras med ca 17,6 MSEK vid utgången av juni (Q2-21). Under Q3-21 uppgick därmed bolagets kapitalförbrukning, s.k. burn rate, till -1,1 MSEK/månad, vilket är något lägre än under t.ex. Q2-21 då AcuCorts burn rate uppgick till -1,4 MSEK/månad. Precis som vi har kommunicerat tidigare till marknaden, senast i samband med Q2-rapporten, har vi i våra modeller dock räknat med att AcuCort under kommande kvartal kommer att ha en något högre kapitalförbrukning. Det i sig är helt naturligt med tanke på den kommande kommersialiseringen av ISICORT®.
Efter tredje kvartalets utgång har AcuCort fyllt på sin kassa genom en fullt säkerställd företrädesemission om ca 26 MSEK, samt genom en riktad emission om ca 5 MSEK, således totalt 31 MSEK före emissionskostnader. Teckningskursen i båda emissionerna, vilka avslutades den 8 november, uppgick till 2,65 kr/aktie. Men hänsyn till att AcuCort i skrivande stund handlas omkring 3,10 kr/aktie, har deltagarna gjort en god affär. Med den utgående kassan per den sista september, samt kapitaltillskottet från emissionerna, har AcuCort en mycket stark finansiell position. Merparten av AcuCorts kassa ska nu investeras i regulatoriska processer och försäljnings- samt marknadsföringsaktiviteter, som ett led på vägen mot en global kommersiell lansering av ISICORT®.
Och det är just så AcuCorts närmaste fokus stavas; kommersialisering av ISICORT®. I ett första skede ser vi att bolaget kommer att lansera läkemedlet brett på hemmaplan, där ett godkännande för den svenska marknaden redan erhållits, samt på andra prioriterade marknader runtom i världen. USA är världens största läkemedelsmarknad och enligt AcuCort lägger bolaget därför stor vikt vid att anpassa den amerikanska registreringsansökan för att optimera ett snabbt och positivt utfall. Vidare har ett så kallat Pre-NDA (New Drug Application) möte med den amerikanska läkemedelsmyndigheten FDA ägt rum och en fortsatt aktiv dialog pågår. Även Europa är en stor och viktig läkemedelsmarknad och arbetet med registreringsansökningarna pågår för att AcuCort via en så kallad Mutual Recognition Process ska kunna registrera ISICORT® på flera marknader inom Europa.
Vad gäller den kommersiella resan skriver AcuCort att de har växlat upp takten i sina dialoger med potentiella partners i Europa, USA och på utvalda nyckelmarknader som har förmåga att lansera ISICORT® på sina respektive lokala marknader. I vår erfarenhet vet vi att det för ett mindre läkemedelsbolag likt AcuCort är mycket fördelaktigt att föra sådana diskussioner med en stark finansiell position. Det skapar ett bättre förhandlingsutrymme och gör att AcuCort kan agera mindre ”stressat” i förhandlingar, vilket i slutändan kan vara helt avgörande för att ett fördelaktigt avtal ska kunna komma på plats. Med den utgående kassan i september, tillkommande nettolikvid från emissionerna och med ett antagande om en genomsnittlig burn rate om -1,5 MSEK/månad, skulle det innebära att AcuCort är finansierade tills slutet av 2023.
Med det i åtanke, och med hänsyn till nuvarande Market Cap om ca 97 MSEK och Enterprise Value (EV) om 56 MSEK, justerat för emissionerna, ser vi en fortsatt attraktiv risk-reward i aktien.
I samband med Q3-rapporten har vi varit i kontakt med Jonas Jönmark, VD på AcuCort.
2021 lider mot sitt slut, vad är du mest nöjd med under året så här långt?
Jag är stolt över mitt team på AcuCort och våra samarbetspartners insatser under året. Våra gemensamma ansträngningar har inneburit att vi har flyttat fram våra positioner vad gäller arbetet med bolagets registreringsansökningar på prioriterade marknader, vilket inkluderar även den viktiga amerikanska marknaden, liksom arbetet vad gäller övriga förberedelser inför den kommande kommersialiseringen. Vi har också fördjupat diskussionerna med ett antal utvalda potentiella väl-renommerade och resursstarka partners med erfarenhet av allergimarknaden, samt med en förmåga att lansera ISICORT® på sina respektive lokala marknader. Vi ser fram emot att landa några av dessa möjligheter i kommersiella samarbeten. Att vårt innovativa läkemedel ISICORT® har visat data på minst tre års hållbarhet och fått stärkt patentskydd är förstås också något som jag är nöjd med.
På vilka aktiviteter bedömer du att ni kommer att lägga störst fokus under 2022?
Givetvis kommer vi lägga största fokus under 2022 på att kommersialisera AcuCorts innovativa läkemedel ISICORT®. Det kräver att vi har samarbetsavtal på plats med rätt kommersiella partners på prioriterade marknader. De pågående dialogerna med potentiella partners kommer således fortsatt att ha stort fokus under det kommande året. Vi vill också accelerera vår tillväxtresa redan från start vilket förutsätter marknadsregistreringar av ISICORT® på ytterligare viktiga marknader. Det innebär i sin tur att högsta prioritet är inlämningen av ansökan om marknadsregistrering i USA, följt av inlämningar av ansökningar om marknadsgodkännande även på andra nyckelmarknader. Vi behöver också få de sista pusselbitarna, enligt vår strategiska kommersialiseringsplan, på plats inför kommersialiseringen.
Vi kommer att återkomma med en uppdaterad version av vår senaste aktieanalys.
Kommentar på AcuCorts Q1-rapport
2021-04-29
AcuCort publicerade igår den 28 april 2021 sin delårsrapport för första kvartalet 2021. Följande är vår uppföljning av rapporten och vad vi främst fokuserat på.
- Kostnadsbasen, tillgänglig likviditet och kapitalförbrukning
- Dialoger med licenstagare kan resultera i en stark trigger
Precis som vi skrivit tidigare bedriver AcuCort fortfarande ett utvecklingsarbete, parallellt med att förberedelserna för den kommersiella fasen fortlöper, varför ingen försäljning är aktuell i dagsläget. Det, i kombination med nödvändiga investeringar och rörelsekostnader, resulterar i ett negativt kassaflöde. Med tanke på vad för typ av bolag AcuCort är och vart de just nu befinner sig i sin utvecklingsfas, är det inget konstigt, samtidigt som det fortsatt är viktigt att effektivt nyttja den likviditeten som finns i bolaget. Vid utgången av första kvartalet uppgick kassan till ca 21,6 MSEK, vilket kan jämföras med ca 24 MSEK vid utgången av december (Q4-20). Under första kvartalet 2021 uppgick därmed bolagets kapitalförbrukning, s.k. burn rate, till -0,8 MSEK/månad, vilket är i linje med genomsnittet för 2020 och således fortsatt lågt. Vi ser såklart positivt på detta, samtidigt som vi dock under kommande kvartal fortsatt räknar med att AcuCort kommer ha en något högre kapitalförbrukning, vilket är helt naturligt med tanke på den kommande kommersialiseringen. Med det sagt, och med tanke på den utgående kassan per den sista mars, anser vi fortsatt att AcuCort har en mycket stark finansiell position.
Under årets första kvartal uppgick AcuCorts totala rörelsekostnader till ca -2,0 MSEK, att jämföra med ca -2,7 MSEK under Q1-20 och -1,9 MSEK under Q4-20. AcuCort utvecklas således fortsatt med en god kostnadskontroll, vilket i sin tur bidragit till den ovannämnda låga kapitalförbrukningen som bolaget uppvisar.
Under våren har AcuCort anställt Louise Harting som projektledare, Louise har en masterexamen i International Business från Copenhagen Business School, och erfarenhet av internationella produktlanseringar inom läkemedelsindustrin från bl.a. Novo Nordisk. I sin roll som projektledare på AcuCort har hon ansvaret för bl.a. ansökningarna om marknadsregistrering av ISICORT® i Norden och Europa. AcuCort fortsätter därmed att addera viktiga pusselbitar för att accelerera utvecklingen i bolaget och öka chanserna för en lyckad marknadsintroduktion av ISICORT®.
Det stora fokuset framgent är hänförligt till just arbetet med att lansera ISICORT® på marknaden vilket inkluderar att allt ska komma på plats så effektivt som möjligt enligt den fastställda planen för att säkerställa en storskalig kommersiell produktion. Det innebär exempelvis att valideringsbatcher och labbanalyser granskas, liksom att kvalitetsparametrar och analyser kontrolleras och följs upp. Parallellt med detta fortsätter de aktiva dialogerna med olika potentiella licenstagare och samarbetspartners. Eventuell kommunikation kring detta, vilket Analyst Group ser som tänkbart under kommande kvartal i år, kan komma att utgöra en stark värdedrivare i aktien. Med det i åtanke, och med hänsyn till nuvarande bolagsvärde om ca 90 MSEK i skrivande stund, ser vi en fortsatt attraktiv risk-reward i aktien.
Vi kommer att återkomma med en uppdaterad version av vår senaste aktieanalys.
Kommentar på AcuCorts Q4-rapport
2021-02-19
AcuCort publicerade igår den 18 februari 2021 sin delårsrapport för fjärde kvartalet 2020. Följande är vår uppföljning av rapporten, vad vi främst fokuserat på samt ett urval av senast händelser kring AcuCort.
- Tillgänglig likviditet och kapitalförbrukning
- Lägre kostnadsbas under Q4
- Godkännande för Covid-19-behandling
- Vad vi har att se fram emot 2021
- Nyligen genomförd VD-intervju med AcuCort
Tillgänglig likviditet och kapitalförbrukning
Med tanke på det utvecklingsarbetet som AcuCort har fokuserat på, och en kommersialiseringsfas som fortfarande är i sin linda, finns ännu ingen försäljning vilket i kombination med nödvändiga investeringar och rörelsekostnader resulterar i ett negativt kassaflöde. Det i sig är inte konstigt, samtidigt som det blir viktigt att effektivt nyttja den likviditeten som finns i bolaget. Vid utgången av fjärde kvartalet uppgick kassan till ca 24 MSEK, vilket kan jämföras med ca 26 MSEK vid utgången av september (Q3-20). Under sista kvartalet 2020 var därmed bolagets operativa kapitalförbrukning, s.k. burn rate, låg och sett till helåret 2020 har denna uppgått till i genomsnitt -0,7 MSEK/månad, vilket vi också anser är lågt och således något vi ser positivt på. Under kommande kvartal räknar vi dock med att AcuCort kommer ha en något högre kapitalförbrukning, vilket är helt naturligt med tanke på den kommande kommersialiseringen. Med det sagt, och med tanke på den utgående kassan per den sista december, anser vi fortsatt att AcuCort har en mycket stark finansiell position.
Lägre kostnadsbas under Q4
AcuCorts rörelsekostnaderna har under sista kvartalet 2020 varit lägre än förväntat, vilket bolaget skriver i huvudsak är på grund av senarelagda kompletterande utvecklingsaktiviteter. Under Q4-20 minskade de externa kostnader med 5 %, från -1,42 MSEK till -1,35 MSEK, och personalkostnaderna minskade med 21 %, från -0,74 MSEK till -0,58 MSEK. Detta har i sin tur bidragit till den ovannämnda låga kapitalförbrukningen som AcuCort uppvisar.
Godkännande för Covid-19-behandling
AcuCort meddelade den 3 februari att det svenska Läkemedelsverket har godkänt bolagets läkemedel ISICORT® för behandling av patienter med Covid-19 som behöver syrgasbehandling. Det godkännande som AcuCort har erhållit avser den svenska marknaden och vår bedömning är att ISICORT® kan komma att fylla ett viktigt behov inom vården. Covid-19-vaccin har rullats ut löpande sedan ett par veckor tillbaka, men ännu är vi långt ifrån en fullgod vaccinering av den svenska populationen. Innan vi når den punkten så finns det ett stort värde av alla typer av produkter, behandlingar, hjälpmedel och läkemedel som kan bidra till en bättre vård av patienter som insjuknat i Covid-19. För AcuCorts del så kan det svenska marknadsgodkännandet och den nu också utökade indikationen komma väl till hands i samband med kommande ansökningar om marknadsgodkännande på fler marknader inom exempelvis Europa och USA. Vi vet också sedan tidigare att AcuCort befinner sig i partnerdialoger avseende den bredare kommersialiseringen av ISICORT®, och det är rimligt att anta att det nyligen erhållna godkännandet för behandling av covid-19-patienter i Sverige stärker AcuCorts position i dessa dialoger.
Vad vi har att se fram emot 2021
Under 2021 kommer AcuCort att lägga ett stort fokus kring aktiviteter för kommersialiseringen av ISICORT®. Precis som bolaget kommunicerat tidigare så kommer detta innebära att fortsätta driva på de pågående dialogerna med tänkbara kommersiella partners som tillsammans med AcuCort kan ansvara för försäljning och marknadsföring av ISICORT® på de lokala marknaderna. AcuCort bedriver även ett intensivt arbete med allt övrigt som behöver vara på plats innan ISICORT® kan vara tillgängligt på marknaden, som t.ex. nationell pris- och subventionsansökan, kommersiell produktion och logistik. Kommunikation från AcuCort rörande framsteg inom dessa processer kan utgöra bra värdedrivare i aktien under 2021.
Nyligen genomför VD-intervju med AcuCort
I samband med pressmeddelandet från den 3 februari vi i kontakt med Jonas Jönmark, VD på AcuCort. Intervjun publicerade vi den 5 februari, och återfinns i sin helhet även här.
Vad betyder godkännandet för AcuCort och när tror du att ni kan börja nå ut med produkten till marknaden?
Det är mycket positivt att Läkemedelsverket har godkänt vårt läkemedel ISICORT® även för behandling av covid-19-patienter. Den utökade indikationen är ytterligare en extern kvalitetsstämpel på vårt arbete och en validering av ISICORT®. Vidare innebär det att sjukvården framgent kan få möjlighet att behandla patienter under syrgasbehandling med ISICORT®. Vår ambition är att ISICORT® kan bli ytterligare ett behandlingsalternativ i kampen mot covid-19.
Indikationen kommer också att finnas med i våra kommande ansökningar om marknadsgodkännande på fler marknader, där vi nu undersöker möjligheterna att få så kallad Fast Track, d.v.s. en påskyndad registreringsprocess som är möjlig för läkemedel avsedda att behandla covid-19-patienter. Vidare styrker den utökade indikationen oss i våra partnerdialoger och i processen att kommersialisera ISICORT®.
Just nu pågår fortlöpande dialoger med potentiella framtida partners som tillsammans med AcuCort kan ansvara för försäljning och marknadsföring av ISICORT® på de lokala marknaderna. Parallellt med dessa aktiviteter fortgår arbetet med allt annat som behöver vara på plats innan den första patienten kan behandlas med ISICORT®. Jag kan inte idag spekulera i när produkten kan tänkas bli tillgänglig på marknaden. Det är flera viktiga steg och processer som behöver hanteras omsorgsfullt, bland annat godkännande av AcuCorts nationella pris- och subventionsansökan, förberedelser för kommersiell produktion och logistik. Vissa av våra aktiviteter är mer tidskrävande än andra, men sammantaget kan jag bekräfta att aktiviteterna hittills fortlöper utan förseningar.
Vi kommer inom kort att återkomma med en uppdaterad aktieanalys.
Kommentar på AcuCorts godkännande för Covid-19-behandling
2021-02-05
AcuCort meddelade den 3 februari att det svenska Läkemedelsverket har godkänt bolagets läkemedel ISICORT® för behandling av patienter med covid-19 som behöver syrgasbehandling.
Studien som riktade strålkastarljuset mot kortisonet dexametason
Den 16 juni 2020 publicerade Reuters, Sveriges Radio med flera medier nyheten om att forskare i Storbritannien hade upptäckt att behandling med kortisonsubstansen dexametason, vilket är den aktiva substansen i AcuCorts produkt ISICORT®, kan reducera dödligheten bland personer som insjuknat i covid-19. I studien, som genomfördes vid Oxford University, konstaterades en minskad dödlighet om 35% för de patienter som behandlades med dexametason och andningshjälp med respirator, jämfört med de patienter som fick hjälp att andas endast med respirator. I den grupp av patienter som behandlades med syrgas, och dessutom fick behandling med dexametason, minskade dödligheten med 20%. Då kortisonsubstansen dexametason visade en ökad överlevnad i covid-19-patienter fick nyheten stor uppmärksamhet runt om i världen.
Sedan dess har AcuCort fortsatt att följa utvecklingen av möjligheterna till att behandla covid-19-patienter med dexametason. Efter att ISICORT® i oktober 2020 blev godkänt av Läkemedelsverket, har bolaget ansökt om att även få indikationen – behandling av covid-19 godkänd. Den 3 februari kom godkännandet från Läkemedelsverket avseende den utökade indikationen för AcuCorts ISICORT®.
”Det godkännande som AcuCort har erhållit avser den svenska marknaden och vår bedömning är att ISICORT® kan komma att fylla ett viktigt behov inom vården. Covid-19-vaccin har rullats ut löpande sedan ett par veckor tillbaka, men ännu är vi långt ifrån en fullgod vaccinering av den svenska populationen. Innan vi når den punkten så finns det ett stort värde av alla typer av produkter, behandlingar, hjälpmedel och läkemedel som kan bidra till en bättre vård av patienter som insjuknat i covid-19. För AcuCorts del så kan det svenska marknadsgodkännandet och den nu också utökade indikationen komma väl till hands i samband med kommande ansökningar om marknadsgodkännande på fler marknader inom exempelvis Europa och USA. Vi vet också sedan tidigare att AcuCort befinner sig i partnerdialoger avseende den bredare kommersialiseringen av ISICORT®, och det är rimligt att anta att det nyligen erhållna godkännandet för behandling av covid-19-patienter i Sverige stärker AcuCorts position i dessa dialoger”, säger ansvarig analytiker på Analyst Group.
I samband med bolagets pressmeddelande har vi varit i kontakt med Jonas Jönmark, VD på AcuCort.
Vad betyder godkännandet för AcuCort och när tror du att ni kan börja nå ut med produkten till marknaden?
Det är mycket positivt att Läkemedelsverket har godkänt vårt läkemedel ISICORT® även för behandling av covid-19-patienter. Den utökade indikationen är ytterligare en extern kvalitetsstämpel på vårt arbete och en validering av ISICORT®. Vidare innebär det att sjukvården framgent kan få möjlighet att behandla patienter under syrgasbehandling med ISICORT®. Vår ambition är att ISICORT® kan bli ytterligare ett behandlingsalternativ i kampen mot covid-19.
Indikationen kommer också att finnas med i våra kommande ansökningar om marknadsgodkännande på fler marknader, där vi nu undersöker möjligheterna att få så kallad Fast Track, d.v.s. en påskyndad registreringsprocess som är möjlig för läkemedel avsedda att behandla covid-19-patienter. Vidare styrker den utökade indikationen oss i våra partnerdialoger och i processen att kommersialisera ISICORT®.
Just nu pågår fortlöpande dialoger med potentiella framtida partners som tillsammans med AcuCort kan ansvara för försäljning och marknadsföring av ISICORT® på de lokala marknaderna. Parallellt med dessa aktiviteter fortgår arbetet med allt annat som behöver vara på plats innan den första patienten kan behandlas med ISICORT®. Jag kan inte idag spekulera i när produkten kan tänkas bli tillgänglig på marknaden. Det är flera viktiga steg och processer som behöver hanteras omsorgsfullt, bland annat godkännande av AcuCorts nationella pris- och subventionsansökan, förberedelser för kommersiell produktion och logistik. Vissa av våra aktiviteter är mer tidskrävande än andra, men sammantaget kan jag bekräfta att aktiviteterna hittills fortlöper utan förseningar.
Kommentar på AcuCorts Q3-rapport
2020-11-13
AcuCort publicerade idag den 13 november 2020 sin delårsrapport för tredje kvartalet 2020. Följande är vår uppföljning av rapporten.
Rapporten i sig innehöll inte några större överraskningar och var väl i linje med våra förväntningar. Vi upplever att AcuCort befinner sig i en verksamhetsmässigt stark trend, där organisationen har tagit flera kliv framåt under det senaste halvåret där viktiga milstolpar har uppnåtts. Om AcuCort kan exekvera sin lagda strategi för kommersialisering av ISICORT®, parallellt med marknadsgodkännande på fler marknader, anser vi att det finns en fortsatt god uppsida i aktien från dagens nivåer.
Närliggande värdedrivare och triggers:
- Uppdatering kring processerna för pris- och subventionsansökan, förberedelser för kommersiell produktion och logistik samt implementering och godkännande av ett uppdaterat kvalitetssystem som möjliggör partihandelstillstånd.
- Uppdateringar kring ansökningsprocesser om marknadsgodkännande för ISICORT® på fler marknader.
- Eventuell kommunikation gällande de dialoger som redan pågår med potentiella framtida partners som tillsammans med AcuCort kan ansvara för försäljning och marknadsföring av ISICORT®.
- En ytterligare potentiell värdedrivare som inte ska glömmas bort är att forskare tidigare i år upptäckte att kortisonsubstansen dexametason, vilken AcuCorts produkt ISICORT® är baserad på, kan reducera dödlighetsgraden bland personer smittade av Covid-19. Exakt vilken väg detta kan ta för AcuCort och vilken möjlighet som finns att söka indikation för Covid-19 för ISICORT®, är för tidigt att säga, men likväl en intressant punkt i den långsiktiga investeringsidén.
En viktig parameter som nämns i rapporten är att ISICORT® har uppnått två års stabilitetsdata, vilket innebär att ISICORT® klarar av minst två års lagerhållbarhet. Detta är en minst sagt stor fördel, och av yttersta vikt, inför den kommande kommersialiseringen.
Världen har under året blivit en annorlunda plats, men AcuCort går till synes från klarhet till klarhet och checkar enligt Analyst Group av delmål efter delmål. Vägen mot kommersialisering känns väl utstakad där AcuCort verkar ha en klar och tydlig uppfattning om vad de måste göra för att lyckas fortsätta leverera värde till aktieägarna. Vi ser fortsatt positivt på AcuCort som investeringsidé och kommer inom kort att återkomma med en uppdaterad aktieanalys.
Intervju med AcuCorts VD Jonas Jönmark i samband med marknadsgodännande av ISICORT
2020-10-12
Den 7 oktober 2020 kommunicerade AcuCort att bolaget erhållit marknadsgodkännande av det svenska Läkemedelsverket för läkemedlet ISICORT®. Analyst Group har i samband med detta kontaktat VD Jonas Jönmark på AcuCort som nu återkommit med en kort intervju.
Skulle du kunna börja med att sammanfatta vad det egentligen innebär för er att ISICORT® nu erhållit ett marknadsgodkännande?
Marknadsgodkännandet är en viktig milstolpe för AcuCort och bolagets första innovativa läkemedel ISICORT®. Godkännandet betyder mycket mer än att läkemedlet är godkänt för kommersialisering och behandling av patienter på den svenska marknaden. Det är även en kvalitetsstämpel från Läkemedelsverket att ISICORT® håller vad vi lovar, både vad gäller effekt och säkerhet samt att vi som bolag lever upp till de högt ställda kvalitetskraven som ställs på oss. Det är ett hårt arbete och en lång process innan ett läkemedel får ett godkännande och det är långt ifrån alla kandidater som når så långt. Att vi rundat milstolpen är både glädjande och inspirerande, och stärker vår bedömning att tiden fram till kommersialisering kan vara relativt kort. Nu kan vi fortsätta att lägga full kraft på implementeringen av vår affärsstrategi.
Kan du utveckla lite mer gällande hur ert nästa steg i er affärsstrategi kommer att se ut, vilka insatser ni kommer fokusera på närmast och vad som måste komma på plats fram tills att den faktiska försäljningen kan påbörjas?
Sverige och det svenska Läkemedelsverket har inom life science-sektorn ett mycket högt anseende i världen. Att vi har erhållit ett marknadsgodkännande i Sverige som första land är en styrka när vi nu kommer att söka godkännanden på fler marknader. ISICORT® är på god väg mot kommersialisering. Arbete som pågår nu är förberedelser för ansökan om marknadsgodkännande på fler marknader, dialoger med potentiella partners för kommersialisering samt ansökan om pris och subventionering, vilket också det sker per land. De partners vi för dialoger med är de som i kommersialiseringen kommer att, tillsammans med AcuCort, ansvara för försäljningen och marknadsföringen av ISICORT® i sina länder och regioner.
Om du för en investerare skulle belysa något som du tycker är extra viktigt att bevaka/hålla utkik efter i närtid, vad skulle du vilja lyfta fram då?
Mycket pågår parallellt och vissa processer kommer naturligtvis att ta längre tid än andra, men med ett marknadsgodkännande i Sverige står vi väl rustade i vår tillväxtresa. Tre viktiga milstolpar framöver skulle jag säga är ytterligare marknadsgodkännanden, godkänt pris och subventionering samt avtal med partners för kommersialisering.
Kommentar på AcuCorts Q2-rapport
2020-08-28
AcuCort publicerade idag den 28 augusti 2020 sin delårsrapport för andra kvartalet 2020. Följande är vår uppföljning av rapporten.
Under årets andra kvartal har AcuCort arbetat intensivt med att ta fram bra underlag till Läkemedelsverket för bolagets ansökan om ett nationellt marknadsgodkännande av ISICORT®. Precis som vi nämnt i vår senaste aktieanalys av AcuCort så tror vi att ISICORT skulle kunna närma sig marknadsgodkännande i Sverige mot slutet av 2020, och att försäljningen då skulle kunna påbörjas under 2021. Ett initialt marknadsgodkännande anses utgöra en potentiellt stark värdedrivare i aktien. ISICORT har som känt väsentliga patientfördelar vilket dessutom ger goda förutsättningar, vid läkemedelsgodkännande, för en omfattande framtida tillväxt och således ytterligare värdeutveckling i aktien.
Parallellt med arbetet för nationellt marknadsgodkännande har AcuCort under Q2-20 även drivit på bolagets övriga utvecklingsarbete, med bl.a. ett flertal partnerdialoger. Vad dessa dialoger kan resultera i är svårt att säga idag, men med tanke på ISICORT:s fördelar och det läget som AcuCort befinner sig i, är det inte omöjligt att positiva överraskningar skulle kunna dyka upp framöver.
En extra krydda finns även i form av de delresultat som Oxforduniversitetet rapporterade från en studie som bl.a. visade att behandling med dexametason, den aktiva beståndsdelen i ISICORT, eventuellt kan ha en positiv effekt på patienter med svåra symptom från Covid-19. Baserat på de preliminära resultaten har den europeiska läkemedelsmyndigheten startat en undersökning om möjligheterna att behandla Covid-19-patienter med dexametason. Det vore såklart minst sagt intressant om AcuCort skulle kunna bidra till att minska dödligheten i rådande pandemi, men som alltid blir det massor av frågor på vägen; vilka doseringar är aktuella, ska intensivvårdspatienter kanske bara injiceras, vad kostar munfilm jämfört med befintliga tabletter osv. Det är således alldeles för tidigt för att göra några konkreta beräkningar kring vad den tänkbara potentialen för AcuCort kan vara, men likväl en intressant faktor att fortsatt bevaka.
Med tanke på det utvecklingsarbetet som AcuCort just nu fokuserar på, finns ännu ingen försäljning vilket i kombination med nödvändiga investeringar och rörelsekostnader resulterar i ett negativt kassaflöde. Det i sig är inte konstigt, samtidigt som det blir viktigt att bevara den likviditeten som finns i bolaget. Vid utgången av kvartalet uppgick kassan till ca 28 MSEK, vilket kan jämföras med ca 31 MSEK vid utgången av mars i år. Under H1-20 uppgick bolagets operativa kapitalförbrukning, s.k. burn rate, till ca -0,8 MSEK/månad, vilket vi anser är lågt och således något vi ser positivt på. En viktig faktor att ta i beaktande är hur länge nuvarande likviditet räcker till. Med avstamp i den utgående kassan per juni månad, historisk burn rate och en uppskattning kring framtida kapitalbehov, räknar vi med att AcuCort är finansierade en bra bit in i 2021.
I samband med rapporten har vi även varit i kontakt med Jonas Jönmark, VD på AcuCort.
Tidigare i augusti tillträdde du som VD för AcuCort. Kan du berätta lite mer om vad det var med AcuCort som fångade ditt intresse?
”AcuCort har funnits på min radar en längre tid, varför jag är extra glad över att få vara en del i att ta bolaget till nya nivåer. AcuCort är ett företag, som med sin innovativa produkt, kan göra stora skillnader för patienter världen över och som jag ser det så står vi väl rustade för att ta vår produkt till marknaden.”
Vi kommer inom kort att återkomma med en uppdaterad version av vår senaste aktieanalys.
Kommentar gällande AcuCorts framsteg i ansökningsprocess
2020-07-20
Den 15 juli 2020 meddelade AcuCort att de bekräftar framsteg i ansökningsprocessen om nationellt marknadsgodkännande för ISICORT®.
”Senaste månaden har AcuCort-aktien rört sig sidledes, samtidigt som bolaget fortsätter att ta steg i rätt riktning. Vi behåller därmed vår värderingsansats där vi fortsatt ser ett riskjusterat nuvärde om ca 6 kr per aktie i ett Base scenario”, säger ansvarig analytiker på Analyst Group.
Kort sammanfattning av nyheten
- AcuCort har mottagit den andra utvärderingsrapporten (Second Round Assessment Report) från Läkemedelsverket i juli enligt plan.
- Efter AcuCorts utvärdering av de återstående frågorna, och med stöd av bolagets regulatoriska expertispartner samt styrelsens ytterligare granskning, är slutsatsen att en stor del av frågorna har besvarats väl och att de utestående frågorna är hanterbara.
- AcuCort kommer att lämna in svarsdossiern avseende den andra utvärderingsrapporten den 11 augusti 2020.
Ansvarig analytiker kommenterar
“Med hänsyn till formuleringarna om att frågorna har besvarats väl, att de utestående frågorna är hanterbara och att AcuCort känner sig säkra på planeringen framöver, ser vi att det är fortsatt sannolikt att ISICORT skulle kunna närma sig marknadsgodkännande i Sverige mot slutet av 2020 och att försäljningen då estimeras kunna påbörjas under 2021. Senaste månaden har AcuCort-aktien rört sig sidledes, samtidigt som bolaget fortsätter att ta steg i rätt riktning. Vi behåller därmed vår värderingsansats där vi fortsatt ser ett riskjusterat nuvärde om ca 6 kr per aktie i ett Base scenario”, säger ansvarig analytiker på Analyst Group.
Ny VD rekryterad
Den 16 juli kom nyheten att rekryteringen av en permanent VD har avslutats och att Jonas Jönmark tillträder som VD den 9 augusti 2020. Jonas har en MBA-examen från Lunds universitet och över 20 års erfarenhet från ledande befattningar och VD-positioner inom läkemedelsindustrin och life science-sektorn. Hans karriär har inkluderat stora internationella läkemedelsföretag som bland annat Pfizer AB, Astellas Pharma A/S och Astra Zeneca Sweden, men också mindre startupbolag som Life Science Support AB och Alteco Medical AB. Jonas har en bred erfarenhet av internationella produktlanseringar, etablering av sälj- och distributionskanaler, kommersiella partnerskap, prissättnings- och ersättningsförhandlingar med myndigheter samt internationell affärsutveckling inom life science.
I samband med att Jonas tillträder som VD under augusti ämnar vi återkomma med en VD-intervju.
Intervju med AcuCorts VD Ann Gidner
2020-06-18
Den 16 juni 2020 publicerades information av Reuters, Sveriges Radio med flera att forskare i Storbritannien har upptäckt att kortisonsubstansen dexametason, vilken AcuCorts produkt ISICORT® är baserad på, kan reducera dödsgraden bland personer smittade av Covid-19. AcuCorts aktie steg kraftigt på nyheten och senaste dygnet har vi uppmärksammat flera dialoger på diverse aktieforum online. Analyst Group har i samband med detta kontaktat VD Ann Gidner på AcuCort för en kort intervju.
Skulle du kunna börja med att helt enkelt sammanfatta vad det egentligen är för något som forskare har upptäckt gällande dexametason och dess effekt på Covid-19?
Det är en opublicerad studie från Oxford University i Storbritannien, där man såg 35 % minskad dödlighet för de patienter som enbart kunde andas med hjälp av respirator och som fick dexametason. Bland de som behandlades med syrgas, minskade dödligheten med 20 %. I förlängningen bidrog läkemedlet till att en av åtta patienter med respirator överlevde. För patienter som fick syrgas överlevde en av 25.
Eftersom dexametason är det första läkemedlet som har visat sig öka överlevnaden i Covid-19, är det här en nyhet som fått stor uppmärksamhet runt om i världen.
Vad får denna upptäckt för effekt på er nuvarande utvecklingsstrategi och fokusområde?
Vår nuvarande utvecklingsstrategi förändras inte i dagsläget, vi driver processen för godkännande av ISICORT vidare, och dessa nyheter påverkar inte den befintliga ansökningsprocessen hos Läkemedelsverket. När man väl gått in med ansökan så är det den man får svar på. Likadant så har vi samma fortsatta plan för fler europeiska länder och för en ansökan i USA, där löper arbetet på. Sen kan en omfattande positiv publicitet kring substansen dexametason ändå vara lite hjälp på vägen för ISICORT indirekt, om myndigheter med flera har tagit del av de positiva nyheterna – då det blir mer kännedom om hur dexametason hjälper patienter generellt.
Ser du det som tänkbart att AcuCort skulle kunna etablera ett segment som riktar sig mot behandling av personer smittade av Covid-19?
När denna och andra pågående studier publiceras, så kan man granska resultaten. Det pågår flera studier med olika förutsättningar, olika doseringar m.m. Om den positiva effekten bekräftas – och det kan bedömas finnas ett fortsatt behov – så kommer AcuCort att kunna ta ställning till ett nytt segment för behandling av den här typen av patienter. Det vore ju fantastiskt att kunna bidra till att minska dödligheten i en svår pandemi. Sen blir det massor av frågor på vägen – vilka doseringar är aktuella, ska intensivvårds-patienter kanske bara injiceras, vad kostar munfilm jämfört med befintliga tabletter, osv – så det är alldeles för tidigt att ge några besked om en tänkbar potential i någon form.
Hur Analyst Group ser på AcuCort som investering
AcuCorts produkt ISICORT® skulle kunna närma sig marknadsgodkännande i Sverige mot slutet av 2020 och försäljningen estimeras då påbörjas under 2021. ISICORT har väsentliga patientfördelar vilket ger goda förutsättningar, vid läkemedelsgodkännande, för en omfattande framtida tillväxt. Bolagets adresserbara marknad bedöms uppgå till 3,4 mdUSD, och ledning och styrelse anses inneha rätt kompetenser för att utveckla Bolaget i en positiv riktning. Genom en rNPV-värdering ges ett riskjusterat potentiellt nuvärde om ca 115 MSEK, motsvarande 6 kr per aktie, i ett Base scenario.
Analyst Groups kommentar kring patentansökans uppdatering
2020-05-29
AcuCort publicerade igår den 28 maj 2020 en kommentar kring uppdatering avseende bolagets andra patentansökan i USA.
”Vi kan förstå att marknadens initiala reaktion är negativ, men vid en djupare analys anser vi att den negativa kursrörelsen är en överreaktion”, säger ansvarig analytiker på Analyst Group.
Tidigare i veckan gjorde det amerikanska patentverket (the US Patent and Trademark Office, USPTO) en uppdatering på sin hemsida avseende AcuCorts andra patentansökan för ISICORT®. Ansökan har fått statusen”Final Rejection Counted, Not Yet Mailed”. Vad det här betyder är att ansökan i dess nuvarande form inte är godkänd samt att AcuCort ännu inte har informerats.
Med en rubriksättning som innehåller ”Final Rejection” kan vi förstå att marknaden reagerar negativt och att aktien som en konsekvens handlades ned under onsdagen den 27 maj. Samtidigt är det på sin plats att ett förtydligande görs kring vad detta faktiskt innebär, där ansökans status, vilken vid en första anblick kan kännas nedslående, inte alls behöver vara så negativ som den kan verka vara. Det är nämligen normalt, och nästan praxis, att handläggare på USPTO utfärdar en eller flera s.k. Office Actions. En handläggare har nämligen endast begränsad tid att pröva en patentansökan och fatta beslut om ansökan ska beviljas eller avslås. För att påskynda en sådan slutsats utfärdar handläggarna ofta en s.k. Final Office Action, eller då Final Rejection. Detta är dock inte ett slutligt beslut att avslå ansökan. Tvärtom, den sökande, i detta fall AcuCort, har ett antal möjligheter att fortsätta granskningen av ansökan, bland vilka kan nämnas: 1) lämna in en begäran om fortsatt granskning, 2) lämna in en ändring i ansökan, 3) lämna in en fortsatt eller uppdelad ansökan, eller 4) lämna in ett överklagande.
Patterson Thuente, en amerikansk advokatbyrå som specialiserar sig på immateriella rättigheter (bl.a. patentansökningar), skriver att under processen för en amerikansk patentansökan kan en andra eller efterföljande Office Actions göras ”Finala” av granskaren. ”Final” är dock en felaktig anmärkning eftersom ett slutligt avslag inte betyder att ansökan för patentet har misslyckats. Det finns faktiskt flera tillgängliga alternativ för att gå vidare med ansökan, exempelvis någon av de fyra alternativ som nämns ovan.
För mer information om hur Patterson Thuente beskriver hur en patentansökan kan gå till i USA och vilka alternativ som finns, läs gärna originalartikeln via följande länk.
”Det är klart att en status om att ansökan godkänts eller gått vidare hade varit mer positiv, men samtidigt är inte USPTO:s utlåtande så negativt som det kan verka. Precis som AcuCort skriver så genomgår patentansökningar i USA ofta flera steg, där man kan fortsätta med fler argument för att få igenom sin ansökan. Vi kan förstå att marknadens initiala reaktion är negativ, men anser samtidigt att kursrörelsen är en överreaktion. Vi ser fortsatt god uppsida i AcuCort och ser ingen anledning att förändra vårt värderingsintervall där vi ser ett motiverat värde om 6,0 kr per aktie i ett Base scenario”, säger ansvarig analytiker på Analyst Group.
I samband med AcuCorts kommentar av uppdateringen avseende den andra patentansökan i USA, har vi varit i kontakt med VD Ann Gidner för hennes kommentar och syn på statusuppdateringen från USPTO.
”AcuCort har redan skydd för ISICORT i USA, genom patentet ”Acute Glucocorticoid Therapy”. Detta patent beskriver medicinsk självbehandling med glukokortikoider i akuta situationer och är giltigt fram till slutet av 2028. För att ytterligare skydda produkten och förlänga exklusiviteten har vi sedan ansökt om ett andra patent vad gäller formuleringen, tillverkningsprocessen och tänkt användningsområde. Det är ett vanligt tillvägagångssätt, att bygga IP-skydd i flera lager runt sin produkt. Även om vi inte lyckades få det andra patentet godkänt i USA i första försöket, så är det bara att arbeta vidare. Vi har duktiga patentjurister som tar sig an detta.”, säger Ann Gidner, t.f. VD på AcuCort.
Kommentar på AcuCorts delårsrapport
2020-04-29
AcuCort publicerade igår den 28 april 2020 sin delårsrapport för första kvartalet 2020. Följande är vår uppföljning på rapporten.
Under februari erhöll AcuCort den första utvärderingsrapporten från Läkemedelsverket av den nationella ansökan om marknadsgodkännande för ISICORT®. Sedan dess har AcuCort lagt ett stort fokus på att ta fram goda underlag för att beskriva produktionsprocessen i mer detalj. Arbetet med svarslistan har även krävt avvägningar i regulatoriska och dokumentationsrelaterade frågor.
Vi har i samband med Q1-rapporten varit i kontakt Ann Gidner, interim VD på AcuCort, för att be henne sammanfatta hur de senaste veckorna fortlöpt för AcuCort.
”Utbrottet av Covid-19 har fått stor påverkan på världen i stort. För AcuCort bedömer vi dock för närvarande att påverkan är begränsad. I nuläget är samarbetet med vår tillverkningspartner och våra regulatoriska experter av stor vikt, och dessa har säkrat en fortlöpande verksamhet med bibehållen kvalitetsnivå. Vi själva har under en tid arbetat en hel del på distans och jag skulle vilja säga att det fungerar bra för oss och ger god koncentration i det nuvarande arbetet med dokumentation. Senaste veckorna har vi som nämnt arbetat intensivt med svarslistan för Läkemedelsverket. I och med att vi nu lägger mindre tid på exempelvis resor till följd av Covid-19, har vi kunnat lägga bra fokus på arbetet med den här rapporten. Vi har också arbetat vidare med en rad praktiska områden, som produktionsplanering, produktutveckling och prissättning”, säger Ann Gidner.
AcuCort ska lämna in sin rapport till Läkemedelsverket den 8 maj.
Under mars deltog AcuCort på BIO-Europe Spring, följande är Ann Gidners sammanfattning av hur konferensen gick:
”Den stora läkemedels- och partnering-konferensen BIO-Europe Spring som skulle hållas fysiskt i Paris under mars blev istället ett digitalt event. Det digitala upplägget funkade förvånansvärt bra och de möten vi hade kändes effektiva och givande. Under konferensveckan hade vi många intressanta möten och dialoger med gott resultat, jag hoppas att vi framöver kan kommunicera mer om detta till marknaden.”
Vi kommer inom kort att återkomma med en uppdaterad aktieanalys.
Analyst Group följer upp AcuCorts kommuniké med en kommentar och VD-intervju
2020-02-26
AcuCort publicerade igår den 25 februari 2020 sin bokslutskommuniké för 2019. Vi har i samband med rapporten kontaktat VD Ann Gidner för att ställa några korta frågor.
Nu är det ungefär två månader sedan du tillträdde som interim VD för AcuCort. Kan du berätta lite mer om vad det var med AcuCort som fångade ditt intresse?
Ja det har varit en intensiv och rolig period att starta upp. AcuCort är ett bolag i spännande läge, eftersom man har en produkt så nära marknad som kan göra riktigt bra patientnytta. För mig personligen är AcuCort väldigt intressant eftersom det inte handlar om ett rent forskningsbolag med många år kvar till marknaden utan en mer mogen fas av kommersialisering och affärsbygge, vilket är min specialitet. Mer precist är det i nuläget mycket viktigt med partnerskap för AcuCort, och jag har bland annat en mångårig bakgrund som internationell Licensierings-direktör för just drug delivery-teknologi.
Under januari 2020 meddelade ni en positiv syn på att utfallet i den andra bioekvivalensstudien för USA inte är ett hinder för att ansöka om marknadsgodkännande av ISICORT® på USA-marknaden. Kan du berätta lite mer om hur du ser på ert kommande arbete kring USA-registreringen?
Det stämmer, tack vare samarbete med vår expertgrupp kom vi fram till en bra plan. Nu ska vi utforma hur den primära planeringen kan tillämpas med den ansökningsväg som är aktuell, och vi tar in lärdomar från processen i Sverige.
Tidigare i februari meddelade ni att ni mottagit den första utvärderingsrapporten från Läkemedelsverket som svar på den nationella ansökan om marknadsgodkännande för ISICORT® i september 2019. Kan du berätta lite mer om hur ni ser på utvärderingen och vad nästa steg blir härifrån?
Ja, Läkemedelsverket har gjort ett gediget arbete. Vi ser ganska många frågor på tillverkningen av munfilmen, vilket troligen hänger ihop med att det just är en nyare administrationsform, inte som vanliga tabletter. Sen i klinik-delen känns det som ett gott mottagande, vilket blir roligt att beskriva mer när vi kommit längre i dialogen med myndigheten. Rapporten har inga formella starka invändningar, vilket är glädjande.
Nu jobbar vi på med att sammanställa kompletterande data och beskrivningar tillsammans med framför allt vår skickliga tillverkningspartner i Frankrike. I maj månad ska vi lämna in svaren, och sedan följer en ny utvärderingsperiod, så vi vet mer framåt halvårsskiftet.
Vad kommer vara ditt och AcuCorts främsta fokus under 2020?
Ett huvudfokus är givetvis det fortsatta arbetet för att nå en färdig produktregistrering för ISICORT i Sverige. Det är en mycket stor milstolpe, och den ger oss lärdomar för det arbetet med Europa och USA. Jag vill också bygga bolagets position och nätverk i en rad olika sammanhang och med dialoger kring licensiering i synnerhet.
Ansvarig analytiker på Analyst Groups kommenterar sin syn på AcuCort som investering
”ISICORT har väsentliga patientfördelar vilket ger goda förutsättningar, vid läkemedelsgodkännande, för en omfattande framtida tillväxt. Bolagets adresserbara marknad bedöms uppgå till omkring 3,4 miljarder dollar, och nuvarande ledning och styrelse anses inneha rätt kompetenser för att utveckla bolaget i en positiv riktning. Genom en rNPV-värdering ges ett riskjusterat nuvärde om 5,2 kronor per aktie i ett Base scenario och 9,3 kronor i ett Bull scenario. Vi ser således en fortsatt uppsida i aktien från dagens nivåer”, säger ansvarig analytiker.
Kommentar inför AcuCorts bokslutskommuniké
2020-02-24
AcuCort publicerar imorgon den 25 februari 2020 sin bokslutskommuniké för 2019. Följande är våra tankar inför rapporten.
”AcuCort har inlett året med starkt positiva nyheter, i samband med rapporten hoppas vi få läsa mer om dessa,” säger ansvarig analytiker på Analyst Group.
För ungefär en månad sedan meddelade AcuCort en positiv syn på att utfallet i den andra bioekvivalensstudien för USA inte är ett hinder för att ansöka om marknadsgodkännande av bolagets läkemedelskandidat ISICORT® på USA-marknaden. Som vi nämnt i vår tidigare kommentar av pressmeddelandet var nyheten minst sagt välkommen där den tillsatta expertgruppen bland annat presenterade handlingsalternativ för att möjliggöra registrering och kommersialisering av ISICORT på den amerikanska marknaden. Det känns även extra betryggande att dessa slutsatser bekräftades av ytterligare två oberoende expertinstanser i USA och Tyskland. Även om kanske ingen ny information kommer att framgå, hoppas vi likväl i samband med morgondagens rapport att få läsa mer om Ann Gidners egna tankar i sitt VD-ord om hur bolaget ser på arbetet kring USA-registreringen.
Under september 2019 lämnade AcuCort in en nationell hybridansökan för marknadsgodkännande av ISICORT till svenska Läkemedelsverket. För mindre än två veckor sedan meddelade AcuCort att myndigheten återkommit med den första utvärderingsrapporten inklusive en översikt och en frågelista. I kommunikationen framgår det att ”[…] Det gavs inga formella starka invändningar (s.k. major objections), och den initiala analysen av rapporten och frågelistan tyder inte på några stora stötestenar.” Att inga starka invändningar eller stora stötestenar fanns är såklart något vi anser är minst sagt positivt. Baserat på aktiens relativt neutrala reaktion på dagen för pressmeddelandet, tror vi att marknaden har missat detta. I morgondagens VD-ord hoppas vi att mer information kan ges kring nyheten, vilket i sig skulle kunna bidra till att marknaden inser nyhetens fulla värde.
I samband med bokslutskommunikén kommer vi att återkomma med en kort kommentar.
AcuCort rapporterar expertgruppens arbete med positivt utfall
2020-01-21
AcuCort meddelade igår en positiv syn på att utfallet i den andra bioekvivalensstudien för USA inte är ett hinder för att ansöka om marknadsgodkännande av bolagets läkemedelskandidat ISICORT® på USA-marknaden. Aktien reagerade minst sagt starkt och var som mest upp hela 34 %.
”Nyheten var minst sagt välkommen där expertgruppen bland annat presenterade handlingsalternativ för att möjliggöra registrering och kommersialisering av ISICORT på den amerikanska marknaden. Det känns även extra betryggande att dessa slutsatser har bekräftats av ytterligare två oberoende expertinsatser i USA och Tyskland. Aktien tog ett glädjehopp på nyheten och steg som högst till 3,45 kr i gårdagens handel, motsvarande en ökning om ca 34 procent. Vi ser fortsatt positivt på AcuCort där ISICORT har väsentliga patientfördelar vilket ger goda förutsättningar, vid läkemedelsgodkännande, för en omfattande framtida tillväxt. AcuCorts adresserbara marknad bedöms uppgå till 3,4 miljarder dollar, och nuvarande ledning och styrelse anses inneha rätt kompetenser för att utveckla AcuCort i en positiv riktning. Analyst Groups senaste rNPV-värdering visar på ett riskjusterat nuvärde om 102 MSEK, motsvarande 5,2 SEK per aktie, i ett Base scenario”, säger ansvarig analytiker på Analyst Group.
Bakgrund till vad som tidigare hänt
AcuCort meddelade i början av november 2019 att de tillsatt en expertgrupp för att utvärdera resultaten av den andra studien för USA-marknaden, med icke-fastande deltagare, där bioekvivalens uppnåddes på två parametrar av tre. Gruppen har analyserat tänkbara orsaker till avvikelsen, och har kunnat belägga den mest troliga. Denna är förknippad med att man i kliniken jämfört två olika orala farmaceutiska beredningsformer, vilket ger vissa skillnader i farmakokinetik.
I gårdagens pressmeddelande framgår information om att expertgruppen har identifierat att studiedesignen hade kunnat innehålla fler mätpunkter. AcuCorts ledning har därför tagit beslut att en farmakokinetisk modellering och simulering ska utföras av externa experter, för att säkerställa bästa möjliga kunskap om produktens uppförande i icke-fastande tillstånd vid fler mätpunkter, inför fortsatt registreringsarbete.
Kommentar från interim-VD
”Eftersom detta i USA är en 505(b)(2)-ansökan och inte en generika-ansökan, ska vissa avvikelser kunna hanteras. Då vi nu har fått de regulatoriska experternas samsyn, så har vi i AcuCort dragit slutsatsen att det finns goda möjligheter att arbeta för USA-registrering. Jag är mycket glad att kommunicera detta. Vi ser med tillförsikt fram emot fortsatt arbete med såväl Sverige- som USA-registreringen enligt plan”, säger AcuCorts interims-VD Ann Gidner.
AcuCort anställer Ann Gidner som interim VD
2019-12-13
AcuCort meddelade igår att VD Mats Lindfors avser minska sitt engagemang i bolaget på grund av familjeskäl., och att Ann Gidner är tillsatt som interim VD från den 1 januari 2020.
Ann Gidner har god erfarenhet från ledande roller inom läkemedel och life science, vilket bland annat innefattar affärsområdeschef på Inceptua GmbH, licensieringsdirektör på Albumedix A/S (Novozymes Biopharma) och VD för läkemedelsstrategibolaget Monocl AB. Gidner sitter även i styrelsen för SenzaGen AB sedan 2014. Ann Gidner är utbildad civilingenjör i bioteknik på Lunds Tekniska Högskola och har en MBA från Lunds universitet.
Nuvarande VD Lindfors kommer övergå från rollen som VD till att stödja AcuCort som konsult, där han fortsatt har ansvar för vissa projekt i AcuCorts affärsplan.
Analyst Group ser det som positivt att avgående VD behåller ett engagemang i bolaget för att underlätta övergången och för att fortsätta de pågående projekten. Vidare är det intressant att följa det arbete och eventuella förändringar som görs av den tillförordnade VDn Ann Gidner och den person som senare rekryteras som ordinarie VD.
Följande kommentarer från involverade nyckelpersoner publicerades i samband med nyheten.
– Jag är oerhört glad över att AcuCort har lyckats knyta till sig Ann Gidner som har gedigen kompetens och internationell erfarenhet inom viktiga områden för bolaget. Att vi dessutom har hittat en lösning som innebär att AcuCorts nuvarande VD Mats Lindfors kan fortsätta att arbeta aktivt som konsult tryggar kontinuitet liksom bra överlämning och ger ett resurstillskott, säger Ebba Fåhraeus, styrelseordförande i AcuCort AB.
– AcuCort är ett spännande bolag och ISICORT® är en innovativ produktkandidat med stor potential. Jag har arbetat med olika aspekter av läkemedelsutveckling och kommersialisering i hela mitt yrkesliv och ser fram emot att leda arbetet vidare mot godkännande och kommersialisering av i första hand ISICORT®, säger AcuCorts tillträdande interim-VD Ann Gidner.
– Dagens tillkännagivande upplever jag som positivt för såväl AcuCort som för mig personligen. Jag har sedan en tid önskat att förändra min arbetssituation. Min nya roll som konsult innebär att jag kan fortsätta arbeta för AcuCort, men i mer begränsad utsträckning, samtidigt som AcuCort tillförs ny kompetens och nya perspektiv. Sammantaget tycker jag att detta är en utmärkt lösning, säger AcuCorts nuvarande VD Mats Lindfors.
Uppföljning på AcuCorts Q3-19
2019-11-20
AcuCort presenterade igår den 19 november sin delårsrapport för tredje kvartalet 2019.
I rapporten noteras inga väsentliga överraskningar. Kostnadsökningen i jämförelse med det andra kvartalet och motsvarande period förra året bedöms bero på utgifter relaterade till processen för godkännande gällande ISICORT® i EU och USA.
Väsentliga händelser under kvartalet är sedan tidigare kända och innefattar främst; namnbyte till ISICORT® från Dexa ODF, ansökan för marknadsgodkännande till Läkemedelsverket, förstärkt patentskydd och genomförd nyemission om cirka 41,2 MSEK.
Efter det tredje kvartalets utgång kom nyheten att ISICORT® inte uppnådde bioekvivalens i den andra bioekvivalensstudien inför registrering i USA. Bolaget har tillsatt en expertgrupp som vidare kommer utreda orsaker till detta och potentiella vägar framåt för kommersialisering i USA. Bolaget kommer att kommunicera status i detta arbete i takt med att det fortlöper. Bioekvivalens uppnåddes på två av tre markörer, vilket innebär att förändringar behöver göras för att även uppnå rätt värde på den tredje markören.
I VD-ordet från Mats Lindfors framgår det att Bolaget gjorde fortsatta framsteg under det tredje kvartalet. Inte minst innebär nyemissionen i september att AcuCort har en starkare finansiell ställning inför det fortsatta arbetet mot kommersialisering av ISICORT® och innebär att ett eventuellt kapitalbehov inte förväntas uppstå förens en god bit in i år 2021 som tidigast. Vidare har AcuCort fått ett patent godkänt av den europeiska patentmyndigheten som förlänger patentskyddet och som enligt Lindfors kommer underlätta kommersialiseringen av ISICORT®. Patentet är samägt med den tidigare tillverkningspartnern LTS Lohmann. I VD-ordet, eller rapporten i övrigt, nämndes inget om samtal med potentiella partners för distribution eller licensiering.
Rörelseresultatet för det tredje kvartalet blev –2,61 MSEK, vilket var lägre än väntat som följd av högre övriga externa kostnader. Detta kan jämföras med –2,23 MSEK under det andra kvartalet. En trolig förklaring till dessa högre kostnader är den fortsatta processen att nå kommersialisering som innefattar regulatoriska kostnader och kostnader för genomförd bioekvivalensstudie m.m.

Vi kommer inom kort att återkomma med en uppdaterad aktieanalys.
Kommentar inför AcuCorts Q3-19
2019-11-18
Imorgon den 19 november publicerar AcuCort sin delårsrapport för tredje kvartalet 2019, följande är våra tankar inför rapporten.
Sammanfattning av händelser under hösten
Under det tredje kvartalet har de främsta händelserna varit att AcuCort skickat in ansökan om marknadsgodkännande för läkemedelskandidaten ISICORT i Sverige och nyemissionen om cirka 41,2 MSEK. Efter kvartalets utgång visade det sig att ISICORT inte uppnådde bioekvivalens i den andra bioekvivalensstudien inför registrering av läkemedelskandidaten i USA.
I slutet av september ansökte AcuCort om marknadsgodkännande för ISICORT i Sverige, som en del i planen att lansera produkten i EU. Vid ett marknadsgodkännande i Sverige kan AcuCort sedan gå vidare till ett eventuellt godkännande i fler EU-länder genom en så kallad Mutual Recognition Process. Sannolikt återkommer Läkemedelsverket med frågor till AcuCort inom några månader och det är först då det kommer visa sig om bioekvivalensstudien för registreringen i USA kommer ha några konsekvenser för ansökningsprocessen i Sverige och vidare EU. Bolaget har kommunicerat att det inte finns någon prognos om datum för eventuellt godkännande.
I slutet av augusti presenterade AcuCort en företrädesemission om 41,2 MSEK före emissionskostnader, vilket var en betydligt större emission än Analyst Group förväntat. Bakgrunden till emissionen var att Bolaget behövde kapital för den fortsatta kommersialiseringsprocessen för ISICORT.
I oktober blev resultaten från den andra bioekvivalensstudien för registrering i USA kända. ISICORT uppnådde inte bioekvivalens då värdet för en av tre markörer föll utanför det godkända intervallet. Konsekvenserna av detta är fortfarande osäkra och AcuCort att tillsatt en expertgrupp som utreder orsaker och alternativ för det fortsatta arbetet mot registrering i USA.
Fokus framgent på läkemedelsgodkännande, partnersamtal och bioekvivalens
De faktorer som investerare bör fokusera på i kvartalsrapporten och tillhörande VD-ord är enligt Analyst Groups bedömning följande:
- Läkemedelsgodkännande. AcuCort har skickat in ansökan för läkemedelsgodkännande för ISICORT i Sverige, som en del i processen att nå godkännande i fler EU-länder. Eventuella uppdateringar gällande denna process och potentiella följder av att ISICORT inte uppnådde bioekvivalens i studier för registrering i USA är viktiga att beakta för investerare.
- För att nå kommersialisering av ISICORT väntas Bolaget behöva ingå samarbete med partners för distribution och/eller licensiering. Inga konkreta samarbetspartners är kända, men enligt tidigare VD-ord förs diskussioner med flera aktörer.
- Bioekvivalens för USA-registrering. Det fortsatta arbetet med att identifiera orsaker och potentiella lösningar för att så snabbt som möjligt göra förändringar som kan leda till att bioekvivalens uppnås. Även eventuella uppdateringar gällande tidsplan och kostnader i samband med arbete mot registrering i USA är viktiga att följa.
Vi kommer att återkomma med en uppdaterad aktieanalys efter rapporten.
AcuCort uppdaterar kring bioekvivalensstudie
2019-11-11
AcuCort gav den 8 november 2019 ytterligare information om resultaten från den andra bioekvivalensstudien inför en USA registrering.
I oktober rapporterade AcuCort resultatet från den sista av två bioekvivalensstudier och läkemedelskandidaten ISICORT® uppnådde inte bioekvivalens på icke-fastande deltagare. Nu lämnar bolaget en uppdatering om det fortsatta arbetet kring bioekvivalensstudien inför USA-registrering.
Kraven för att uppnå bioekvivalens innefattar tre mätparametrar där utfallet måste vara inom ett visst intervall, som sätts i relation till en sedan tidigare godkänd referensprodukt. ISICORT® uppnådde bioekvivalens på två av tre mätparametrar, men inte på den tredje parametern (kallad Cmax) gällande den maximala mängd aktiv substans som uppmäts i plasma på deltagarna. Anledningen till att ISICORT® inte uppfyllde kravet för Cmax var att värdet var för lågt i relation till referensprodukten. ISICORT® uppfyllde inte heller kraven för parametern Tmax, vilket inte är ett krav för bioekvivalens men ändå anses viktig. Tmax beskriver hur lång tid det tar att uppnå den maximala mängden aktiv substans i plasma och AcuCorts läkemedelskandidat utföll långsammare i relation till referensprodukten.
Efter studieresultaten blev kända har AcuCort tillsatt en expertgrupp för att utreda följande punkter:
- Orsaken till utfallet.
- Presentera handlingsalternativ för att möjliggöra fortsatt registrering av ISICORT® i USA.
- Utvärdera konsekvenserna av de olika handlingsalternativen.
Hittills har möjliga orsaker till utfallet identifierats och arbetet att utvärdera dessa pågår.
Gällande eventuella konsekvenser för marknadsgodkännande i Sverige blir dessa inte kända innan Läkemedelsverket inkommer med frågor till AcuCort, vilket förväntas ske som tidigast under första kvartalet nästa år.
”AcuCorts målsättning att registrera och kommersialisera ISICORT® ligger fortsatt fast. Vi har stort förtroende för expertgruppen och kommer att informera om status i takt med att arbetet går framåt”, säger Mats Lindfors, VD för AcuCort.
Denna nyhet innehåller inga konkreta besked vad nästa steg kommer vara eller hur tidsplan och kostnader påverkas av att inte uppnå bioekvivalens. Det är däremot positivt att marknaden får besked om vilka delar som inte uppnådde bioekvivalens och att bolaget arbetar med att utforma en konkret plan för vägen framåt.
Det finns exempel på andra bolag vars produkt först inte uppnått bioekvivalens men som efter justeringar har lyckats korrigera de variabler som skilde sig mot referensprodukten. Exempelvis lyckades Enorama Pharma uppnå bioekvivalens på cirka två månader efter en studie där de inte uppnådde bioekvivalens. Givetvis har AcuCort en helt annan produkt och det är möjligt att Enorama Pharmas nikotintuggummi skilde sig relativt lite mot referensprodukten från början och därför lyckades göra snabba justeringar. Innan vidare besked ges från AcuCort går det inte att spekulera gällande tidsplan för ny bioekvivalensstudie men det kan konstateras att det är möjligt att göra justeringar för att korrigera de variabler som skiljer sig mot referensprodukten.
AcuCorts läkemedelskandidat ISICORT® uppnådde ej krav på bioekvivalens i USA
2019-10-16
Igår den 15 oktober 2019 presenterade AcuCort resultat från den andra av två bioekvivalensstudier för registrering av läkemedelskandidaten ISICORT®.
Bioekvivalensstudien gjordes på icke-fastande deltagare och i jämförelse med en redan godkänd referensprodukt, där ISICORT® uppnådde bioekvivalens i två av tre kriterier. Eftersom värdet inte hamnade inom godkända intervall för alla tre kriterier så uppnåddes inte heller tillräcklig bioekvivalens för registrering i USA.
Tidigare har AcuCort utfört bioekvivalensstudier på fastande deltagare för registrering i USA och då uppnåddes bioekvivalens. Enligt Analyst Groups bedömning är det troligt att detta kommer påverka kostnadsbilden och tidsplanen för marknadsgodkännande i USA, men det är inget som bolaget ännu har uttalat sig om. AcuCort kommer fortsatt arbeta mot kommersialisering i USA och kommer tillsammans med relevanta experter utvärdera vilka handlingsalternativ som är bäst i dagens situation.
Resultatet från bioekvivalensstudien på icke-fastande deltagare kommer inte ha någon påverkan för ansökan om marknadsgodkännande i Sverige, och vidare EU, eftersom det i detta fall enbart krävs bioekvivalensstudie på fastande deltagare. Den genomförda bioekvivalensstudien på fastande deltagare ligger till grund för den inskickade ansökan om marknadsgodkännande i Sverige.
Analyst Group har ställt några korta frågor till VD Mats Lindfors.
Vad innebär det att bioekvivalens inte har uppnåtts för ansökan i USA?
Vi har uppnått bioekvivalens med fastande deltagare, men inte med icke-fastande. Vi kommer att undersöka såväl konsekvenser som möjliga handlingsvägar framåt.
Vilka steg kommer ni ta för att uppfylla de amerikanska kriterierna?
Det är idag för tidigt att kommentera. Vi har nu kommunicerat resultatet och som jag nämner i PM:et så behöver vi, givetvis tillsammans med relevanta experter, analysera och undersöka och värdera vilka möjligheter som erbjuds för att ta ISICORT vidare mot registrering och kommersialisering.
Kommer detta signifikant påverka tidsplanen för godkännande i USA?
Det är för tidigt att kommentera.
Hur stora kostnader kan väntas som konsekvens av att inte uppnå bioekvivalens?
Det är för tidigt att kommentera.
Kommer detta ha någon påverkan på ansökan om marknadsgodkännande i Sverige?
Sverige och EU kräver inte studier med icke-fastande deltagare för godkännande. Det är dock för tidigt att förutspå eventuell påverkan av utfallet från USA studien på den svenska ansökan.
Läs mer om AcuCort här
AcuCort justerar strategin för ansökan om marknadsgodkännande av ISICORT® inom EU
2019-09-05
AcuCort har presenterat en justering av strategin för ansökan om marknadsgodkännande av ISICORT® inom EU.
Justeringen av strategin innebär att registreringsprocessen börjar med en nationell hybridansökan i Sverige, för att sedan följas av en ansökan för fler EU-länder via Mutual Recognition Processen (MRP), givet godkännande i Sverige. Syftet med justeringen är enligt AcuCort att snabbt och säkert nå ett godkännande av läkemedelskandidaten ISICORT® brett inom EU.
Det finns flera regulatoriska vägar mot att nå godkännande inom EU och tillsammans med den regulatoriska partnern ProPharma Group har bolaget utvärderat olika alternativ sett till risker, tidsplaner och kostnader. Vid övervägning av dessa faktorer är slutsatsen att AcuCort kommer justera strategin till en hybridansökan som startar i Sverige och fortsätts genom MRP vid godkännande i Sverige. Tidigare var strategin att genomföra en hybridansökan i en så kallad Decentraliserad Process (DCP), som innebär att ett referensland utvärderar ansökan om godkännande för flera länder i ett och samma steg. Detta valdes bort i samråd med ProPharma Group eftersom risken att ansökan skulle bli mer tidskrävande, på grund av förhandlingar med fler länder samtidigt, ansågs vara större.
Det första steget i processen väntas inledas under de närmaste veckorna genom att en nationell hybridansökan lämnas in i Sverige. Jämfört med tidigare strategi förväntar sig AcuCort ingen väsentlig kostnadsförändring i och med den justerade strategin.
”Jag är övertygad om att två-stegslösningen representerar det bästa regulatoriska vägvalet för AcuCort och jag ser med tillförsikt framemot den fortsatta vägen mot kommersialisering av ISICORT®”, säger Mats Lindfors, VD på AcuCort.
Analyst Group bedömer nyheten som positiv, då beslutet att justera strategin visar att samarbetet med regulatoriska partners är fruktsamt och att arbetet mot läkemedelsgodkännande underlättas av extern kompetens. Förhoppningsvis innebär den uppdaterade strategin att ISICORT® blir godkänt snabbare och att kommersialiseringen inom EU sker tidigare än förväntat.
AcuCort genomför emission
2019-08-29
AcuCort presenterade den 27 augusti en företrädesemission vilken vid full teckning tillför AcuCort 41,2 MSEK, före emissionskostnader.
Bakgrunden till nyemissionen är att bolaget behöver kapital för att fortsätta arbetet mot kommersialisering av läkemedelskandidaten ISICORT®. AcuCorts produkt ISICORT® är ett läkemedel mot svåra och akuta allergiska reaktioner, i form av en tunn film som upplöses på patientens tunga. För att nå kommersialisering behöver AcuCort genomföra den pågående bioekvivalensstudien med positiva resultat, få läkemedelsgodkännande från EU och amerikanska myndigheter, sluta avtal med kommersiella partners för distribution och/eller licensiering samt utveckla varumärket ISICORT®. Denna process är kapitalintensiv och därför genomför AcuCort nu en nyemission.
Information om nyemissionen
- Avstämningsdagen är den 3:e september.
- Teckningsperiod mellan 6-20 september.
- För varje befintlig aktie på avstämningsdagen har aktieägare företrädesrätt att teckna en ny aktie.
Fördelning av emissionslivkvid
- Regulatoriska processer; 35 procent
- Försäljning och marknadsföringsaktiviteter; 10 procent
- Förstärkning av rörelsekapital; 17 procent
- Immateriella rättigheter; 5 procent
- Företagsledning och administration; 25 procent
- Farmakovigilans; 8 procent
Regulatoriska processer samt företagsledning och administration är de största posterna, vilka är hänförliga till processen att få ett beviljat läkemedels- och marknadsgodkännande samt kostnader för övriga steg som måste tas för att nå kommersialisering.
Storleken på emissionen var större än vad vi förväntat. Trots att detta innebär större utspädning än väntat för aktieägares befintliga innehav, innebär också storleken på nyemissionen att bolaget står på stabilare finansiella grunder inför kommersialisering. Detta reducerar osäkerheten kring AcuCorts finansiella ställning framgent och ger bolaget möjlighet att fokusera på kommersialiseringen.
Kort intervju med VD Mats Lindfors
AcuCort genomför nu en emission om ca 41 MSEK före emissionskostnader – bedömer ni att denna kommer bli den sista kapitalanskaffningen bolaget gör innan ni når break-even?
Villkorat att emissionen fulltecknas, och att vi uppnår våra mål i affärsplanen så är det mycket möjligt att detta är den sista kapitalanskaffningen.
Finns det någon uppdatering kring den tidigare kommunicerade tidsplanen att vänta?
Vi kommer att kommunicera uppdateringar när det finns ny pålitlig data tillgänglig.
Kan du berätta lite mer om vad som innefattar”företagsledning och administration” gällande er allokering av emissionslikviden?
Personal d.v.s. anställda inkl. utbyggnad av organisationen samt styrelse och vissa konsulter är den dominerande delen. Kostnader för att bygga upp ett kvalitetssystem i samband med att bolaget blir innehavare av marknadstillstånd är en annan viktig del, likaså kostnader för att införa så kallad serialisering i produktionen. Serialisering är en kvalitetssäkringsåtgärd för att kunna spåra produkter ner på förpackningsnivå.
AcuCort presenterade idag sin kvartalsrapport för det andra kvartalet 2019
2019-08-16
I rapporten noteras inga väsentliga överraskningar, även om rörelseresultatet var cirka 1 MSEK lägre än estimerat som följd av något högre övriga externa kostnader. Kostnadsökningen i jämförelse med det första kvartalet bedöms bero på utgifter relaterade till godkännandeprocessen för Dexa ODF i EU och USA.
Under det andra kvartalet har AcuCort valt Öhrlings PricewaterhouseCoopers AB som revisionsbolag, vilket har inneburit förändringar i den historiska redovisningen av immateriella tillgångar för åren 2012 och 2013. Detta har emellertid inte fått några konsekvenser för bolagets rörelse, resultat eller kassaflöde. Framgent kommer AcuCort redovisa aktiverat arbete för egen räkning uppdelat på varje kvartal, istället för enbart i det fjärde kvartalet som tidigare varit fallet.
I VD-ordet från Mats Lindfors framgår det att Bolaget har gjort fortsatta framsteg. AcuCorts regulatoriska partner, Sofus ProPharma, arbetar intensivt med sammanställningen av ansökan för godkännande av Dexa ODF i EU. Vidare har Bolaget fått klartecken att påbörja den andra bioekvivalensstudien i USA som kommer ske med icke-fastande deltagare, detta efter ett positivt resultat från den första studien. Lindfors kommenterar också beskedet från det europeiska patentverket att godkänna patentansökan för ”Dexamethasone ODF” och menar att patentet stärker Bolagets förhandlingsposition i diskussioner med potentiella kommersiella partners.
Vid en extra bolagsstämma i juni gavs styrelsen bemyndigande att besluta om nyemission vid ett eller flera tillfällen innan nästa årsstämma. AcuCort förväntas genomföra en nyemission under det andra halvåret 2019, i syfte att finansiera den fortsatta processen att nå kommersialisering. Med utgångspunkt i att Bolagets kostnader fortlöper i ungefär samma takt som under det första halvåret kommer ett kapitaltillskott vara nödvändigt innan årsskiftet. Dagens rapport innehöll däremot inte vidare information om när nyemissionen väntas presenteras.
Rörelseresultatet för det andra kvartalet blev -2,2 MSEK, vilket var lägre än väntat som följd av högre övriga externa kostnader. Detta kan jämföras med -1,4 MSEK under första kvartalet (Q1-19). En möjlig förklaring till de högre kostnaderna är en intensifiering av processerna kring läkemedelsgodkännande, vilket bl.a. medför kostnader för konsulter m.m. Analyst Group kommer inför analysuppdateringen undersöka detta vidare.

Vi kommer inom kort att återkomma med en uppdaterad aktieanalys
AcuCort publicerar imorgon sin Q2-rapport
2019-08-15
Imorgon den 16 augusti publicerar AcuCort sin delårsrapport för andra kvartalet 2019, följande är våra tankar inför rapporten.
Fortsatt arbete för att nå kommersialisering av Dexa ODF
Under kvartalet har AcuCort fortsatt ta steg mot marknadsgodkännande och kommersialisering av läkemedlet Dexa ODF, detta har exempelvis mynnat ut i ett myndighetsgodkännande efter det andra kvartalets utgång att genomföra den återstående bioekvivalensstudien i USA. Studien är av stor betydelse för AcuCort eftersom den är avgörande för godkännande för försäljning i USA. Bioekvivalensstudien kommer kunna starta redan under tredje kvartalet 2019. Vidare har Bolaget fortsatt fört samtal med potentiella partners och det bedöms vara avgörande för en lyckad kommersialisering att AcuCort hittar en eller flera lämpliga partners för licensiering eller distribution.
De finansiella räkenskaperna för det andra kvartalet väntas inte innehålla några större överraskningar, utan till stor del vara lik föregående kvartal. Vi kommer först och främst titta närmare på rörelsekostnaderna, vilka estimeras uppgå till ca -1,4 MSEK. Aktiverat arbete för egen räkning estimeras kring 0,25 MSEK, vilket ger ett förväntat rörelseresultat om ca -1,15 MSEK. Inga kommunicerade händelser har skett under kvartalet som bedöms ha påverkat rörelsekostnaderna till en betydande grad.
Under kvartalet har AcuCort valt Öhrlings PricewaterhouseCoopers som revisionsbolag, vilket har lett till vissa förändringar i redovisningen. Framgent kommer AcuCort redovisa aktiverat arbete för egen räkning för varje kvartal, istället för en gång per år under det fjärde kvartalet. Det innebär att rörelseresultatet, likt under Q2-19, även för resterande kvartal kommer att öka.
Fokus på utveckling inom läkemedelsgodkännande, partnersamtal och kapitalbehov
De faktorer som investerare bör fokusera på i kvartalsrapporten och tillhörande VD-ord är enligt Analyst Groups bedömning följande:
- Läkemedelsgodkännande. Kommande kvartal väntas fortsatta bioekvivalensstudier för eventuellt godkännande av Dexa ODF i USA. Även uppdateringar om produktgodkännandeprocessen i EU, där AcuCort samarbetar med Sofus Regulatory Affairs, är viktiga att följa.
- Partnersamtal. För att nå kommersialisering av Dexa ODF väntas Bolaget behöva ingå samarbete med partners för distribution och/eller licensiering. Inga konkreta samarbetspartners är kända, men enligt föregående VD-ord förs diskussioner med flera aktörer.
- Kapitalbehov. Det fortsatta utvecklingsarbetet, diverse förberedelser för kommersialisering, samt ansökningsprocesser väntas kräva en nyemission under andra halvåret 2019.
Vi kommer att återkomma med en uppdaterad aktieanalys efter rapporten.
Uppföljning på AcuCorts Q1-19
2019-05-17
AcuCort (”AcuCort” eller ”Bolaget”) publicerade idag den 17 maj sin delårsrapport för Q1-19. Nedan följer Analyst Groups tankar om rapporten.
I rapporten syns inga större överraskningar, med undantaget att Bolagets burn rate var lägre än väntat, vilket är positivt. Trots hög aktivitet under kvartalet på det regulatoriska planet lyckas Bolaget hålla nere kostnaderna, vilket är positivt inför framtida stundande nyemission.
I VD Mats Lindfors VD-ord framgår att mycket positivt har hänt kring Bolaget under kvartalet. Vidare framgår även att AcuCort har upplevt ett stort intresse för Dexa ODF under Bio-Europe-konferensen i Wien, som ägde rum mot slutet av mars. Tack vare läkemedlets regulatoriska framsteg har intresset för Dexa ODF ökat, och flertalet sekretessavtal angående samtal kring potentiellt samarbete har skrivits på. Detta är en väsentlig del för Bolagets framtid, och en av de viktigaste delarna att följa i AcuCorts framtida utveckling. Därav är det helt klart positivt med ett så stort intresse för produkten.
Vad gäller Bolagets finansiella utveckling under kvartalet lyckades AcuCort hålla nere kostnaderna, och levererade ett bättre resultat än väntat. Trots hög aktivitetsnivå levererar Bolaget en EBIT på -1,37 MSEK. Detta är en något förbättrad siffra till följd av att Bolaget aktiverar utgifter till balansräkningen, vilket förbättrar resultatet men förstorar balansräkningen. Justerat för detta, om Bolaget hade kostnadsfört samtliga kostnader, hade EBIT rapporterats till -2,38 MSEK. Trots detta är det fortfarande en lägre siffra än vad vi förväntade, och att Bolaget lyckas leverera en så låg kostnadsnivå är positivt. Bolagets burn rate låg på -2,7 MSEK. Sammantaget bedöms rapporten vara ett styrkebesked på alla fronter, där Bolagets låga kostnadsnivå samt att ett antal sekretessavtal med potentiella partners har slutits indikerar en positiv framtid för AcuCort.

Analyst Group kommer återkomma med en uppdaterad analys inom kort.
Kommentar inför AcuCorts Q1-19
2019-05-16
AcuCort (”AcuCort” eller ”Bolaget”) publicerar imorgon sin delårsrapport för Q1-19. Följande är Analyst Groups tankar inför rapporten.
AcuCorts första kvartal har präglats av flertalet händelser, med en godkänd bioekvivalensstudie i EU och en av två bioekvivalensstudier godkända i USA. Vidare har även Bolaget börjat genomföra den andra studien i USA, vilket väntas ge svar inom en snar framtid.
Bolaget har även anlitat Sofus Regulatory Affairs, en konsult inom regulatoriska ärenden som kommer hjälpa Bolaget att sammanställa sin ansökan för läkemedelsgodkännande inom EU.
Det är mycket som har hänt kring AcuCort under det senaste kvartalet som har påverkat värdet på Bolaget, och det kommer bli intressant att läsa hur VD Mats Lindfors uttalar sig om framtiden samt om han har någon kommentar på hur den andra bioekvivalensstudien i USA går.
Främst kommer fokus ligga på Bolagets burn rate under kvartalet, där kassan är högst intressant att följa i och med den kommunicerade nyemissionen som stundar under 2019. Denna kommer vara högst relevant för framtiden, och trots att den är kommunicerad verkar marknaden visa upp en osäkerhet kring just denna och därav kommer det bli intressant att se om Bolaget nämner något om en plan för detta i morgondagens rapport.
Vidare vill vi se se hur Bolagets fortsatta arbete med att hitta potentiella samarbetspartners för Dexa ODF går. Detta bedöms vara den största risken i Bolaget förutom den läkemedelsspecifika risken, och blir därför intressant att följa.
Avslutningsvis väntas rapporten vara en rapport som egentligen inte bjuder på några större överraskningar. Kostnadsmassan bedöms ligga på en relativt hög nivå till följd av Bolagets höga aktivitet under kvartalet. Detta är en effekt av att AcuCort fortsätter sitt arbete mot marknadslansering, och visar på Bolagets fortsatta framfart.

Acucort senarelägger ansökan om produktgodkännande
2019-03-18
AcuCort (”AcuCort eller ””Bolaget”) meddelade igår om att studieansökan för läkemedelsgodkännande i EU kommer att förskjutas.
Förskjutningen blir från Q2-19 till Q3-19. Detta till följd av att produkten som Bolaget ansöker med måste klara av att bevaras under en 12-månadersperiod under specifika förhållanden för att kunna användas som ansökningsobjekt, detta enligt regulatoriska skäl.
Förskjutningen kommer inte att påverka Bolagets verksamhet väsentligt, då det inte har något med produktens egenskaper att göra, utan endast att uppfattningen hos Bolaget tidigare har varit att det räckte med att förvara produkten i en 6-månadersperiod. Detta kommer dock innebära att den planerade lanseringen av produkten kommer skjutas upp. Försäljningsstarten av produkten är att anse som en väsentlig potentiell trigger för aktiekursen, något som nu skjuts upp. Samtidigt finns det andra tydliga triggers i Bolagets närtid, främst ett samarbetsavtal, som ligger närmast som den mest aktuella, något som är en väsentlig del på vägen mot marknadslansering. Sammanfattningsvis påverkar inte gårdagens PM verksamheten i en större utsträckning då det inte påverkar storleken på de framtida kassaflödena, och är inte heller någon grav försening av den tidigare publicerade tidsplanen.
Vidare kommer det även bli intressant att se VD Mats Lindfors presentation under dagen för att se hur verksamheten går och hur AcuCort ser på framtiden.
Analytikerkommentar på AcuCorts delårsrapport för Q4-18
2019-02-19
AcuCort (”AcuCort” eller ”Bolaget”) publicerade den 23 januari sin delårsrapport för Q3-18. Nedan är vår sammanfattning av rapporten samt hur vi ser på AcuCort framgent.
Status 2019
Under de senaste månaderna har det hänt många intressanta skeden kring AcuCort, och Bolaget har tagit stora steg fram mot marknadsgodkännande och kommersialisering av Dexa ODF. Bolaget har under den senaste perioden fått en godkänd bioekvivalensstudie i EU, börjat genomföra sin bioekvivalensstudie i USA samt anlitat konsulten SOFUS Regulatory Affair, för att färdigställa Bolagets ansökan om läkemedelsgodkännande i EU.
Chanserna för ett positivt utfall bedömdes till 70 % innan resultatet publicerades. Bolaget har sedan tidigare genomfört en studie som var snarlik den som precis utförts, med den enda stora skillnaden att tillverkningen utfördes av ett annat bolag. Adhex Pharma, det bolag som AcuCort nu använder sig av väntas leverera de filmer som kommer att användas för Bolagets studier för ett godkännande i USA och Asien, vilket är en av anledningarna till att risken för dessa nu bedöms vara betydligt lägre än tidigare.
Att den läkemedelsspecifika risken i Bolaget sjunker påverkar värderingen
Tidigare bedömdes en sannolikhet för godkännande till 70 %. I och med den godkända studien skapas nu en ojämnt fördelad risk mellan de olika geografiska marknaderna. I EU är risken inte utraderad, men mycket talar för att att läkemedlet blir godkänt högt, då endast en läkemedelsansökan kvarstår. I de övriga primära marknaderna, Asien och Nordamerika, bedöms även risken nu vara lägre än tidigare.
Att AcuCort har visat på att läkemedlet håller en hög standard med tillverkaren Adhex Pharma i och med bioekvivalensstudien, bidrar till att chansen för att godkännande i dessa områden blir högre. Sammantaget kommer dessa faktorer påverka värderingen av AcuCort positivt.
Vad som nu väntar är ett större fokus på hur AcuCorts arbete med potentiella samarbetspartners fortgår. Bolaget börjar närma sig ett läkemedelsgodkännande inom EU som beräknas ske mot slutet av 2019, och en påbörjad försäljning under 2020. För att möjliggöra detta krävs ett gediget arbete för att lyckas nå avtal med så kompetenta partners som möjligt.
VD Mats Lindfors har under hösten arbetat hårt mot detta mål, Mats medverkade på en stor läkemedelskonferens i Köpenhamn under november, och har kommunicerat att han för samtal med ett antal intressanta aktörer. Han kommer även fortsätta med detta arbete under 2019, och med tanke på de patientfördelar som Dexa ODF kan påvisa, väntas det finnas ett stort intresse för produkten finnas hos potentiella partner, och därav väntas Bolaget lyckas sluta ett avtal.
Kommentar på bokslutskommunikén
AcuCorts Q4 kom inte med några överraskningar. Bolaget fortsätter sitt arbete enligt tidsplan som tidigare kommunicerats, och inget oväntat presenterade sig i rapporten. Bolaget kommunicerade att en nyemission är att vänta under den kommande 12-månaderspersioden, vilket är något som tidigare kommunicerades i samband med den tidigare emissionen, och är därav inget oväntat besked. I övrigt syns inga egentliga överraskningar i rapporten, Bolaget fortsätter med sitt arbete och Analyst Group går in i 2019 med positiv inställning till AcuCort och utvecklingen av Dexa ODF.
Sammantaget finns det anledning att vara positiv till AcuCorts verksamhetsutveckling framgent.
Analyst Group kommer att återkomma med en uppdaterad aktieanalys inom snar framtid.
Analytikerkommentar på AcuCorts delårsrapport Q3-18
2018-11-07
AcuCort AB (”AcuCort” eller ”Bolaget”) publicerade idag den 7 november sin delårsrapport för tredje kvartalet 2018. Nedan framgår våra tankar om rapporten.
Dexa ODF-studier går enligt tidsplan
Under det andra halvåret 2018 har AcuCort inlett studier med hjälp av Quinta-Analytica, som sedan skall användas som underlag för ansökningar om läkemedelsgodkännande i EU och USA. Att få en statusuppdatering angående hur denna process har utvecklat sig hittills var därför den punkten Analyst Group fokuserade på mest innan rapport. I rapporten kan vi utläsa i Mats Lindfors VD-ord att dessa studier går enligt tidsplan. Vi kan luta oss mot historien och se att Bolaget hittills har hållit vad de har lovat inom uttalad tidsplan när sådana uttalanden tidigare gjorts. Därav drar Analyst Group slutsatsen att detta är ett positivt uttalande av Mats, och är fortsatt positiva till hur studiens utfall blir.
Vidare såg vi att kostnadsmassan var högre än förväntat. Det är möjlig att denna kostnad är hänförlig till Bolagets möte med FDA. Läkemedelsprocessen inom USA prognostiseras vara den mest kostsamma av alla regioner Bolaget kommer söka till, och därav ses detta som en logisk förklaring till att kostnaderna inte låg i linje med Analyst Groups estimat. Vidare väntas kostnadsmassan vara fortsatt hög under Q4-18, till följd av att majoriteten av kostnaderna relaterade till Quinta-Analyticas studie av Dexa ODF väntas bokas in under denna period.
Analyst Group anser att Q3-rapporten var bra, kostnadsöverraskningen till trots. Här låg dock inte fokus inför rapporten, utan det vi såg mest fram emot var VD-ordet och kommentar kring hur studien av Dexa ODF har utvecklats. AcuCort gav bra information kring detta och Analyst Group är fortsatt positiva till Bolagets framtid. AcuCort går nu in i en spännande fas med där flera potentiella värdedrivare kan inträffa, t.ex. positiva studieresultat eller påskrivet samarbetsavtal med en partner. Det kan komma att driva på värderingen av Bolaget och aktien.
Analytikerkommentar inför AcuCorts delårsrapport för Q3-18
2018-11-06
AcuCort AB (”AcuCort” eller ”Bolaget”) publicerar imorgon den 7 november sin delårsrapport för tredje kvartalet 2018. Följande är våra tankar inför rapporten.
Den senaste perioden för AcuCort har varit händelserik. Bolaget har under de senaste månaderna slutfört produktionen av de exemplar av Dexa ODF som används under Bolagets studier, genomfört en övertecknad företrädesemission om 10,8 MSEK (efter emissionskostnader), haft ett möte med FDA angående ansökningsprocessen för läkemedelsgodkännande.
I rapporten ser vi fram emot att läsa om en statusuppdatering angående hur AcuCorts studier fortskrider. Studierna har påbörjats, och beroende på status kan detta ses som en potentiell trigger.
Vidare blir det även intressant att titta på hur Bolaget hanterar kostnaderna. Rörelsekostnaderna väntas sjunka kraftigt jämfört med Q2 2018. Detta till följd av att majoriteten av kostnaderna då bestod av kostnader relaterade till Adhex Pharma. Under Q3-18 väntas Bolagets kostnadsmassa ha återgått till mer normala nivåer. Extraordinära kostnader under kvartalet väntas främst vara relaterade till Quinta-Analytica, alltså den pågående studien. I samband med nyligen genomförd nyemission guidade Bolaget för hur stor kostnadsmassan kommer att vara för studien. Frågan är hur stor del av denna kostnad som bokats under Q3-18. Analyst Group estimerar att ca 20 % av denna summa, cirka 400 tSEK kommer bokas under Q3-18.
Sep
Intervju med AcuCorts VD Mats Lindfors
Nov
Aktieanalys på AcuCort Q3-18
Aktiekurs
N/A
Värderingsintervall
2025-08-28
Bear
0,5 SEKBase
1,1 SEKBull
1,8 SEKUtveckling
Huvudägare
2025-06-30



Kommentar på AcuCorts Q2-rapport
2025-08-19
AcuCort (”AcuCort” eller ”Bolaget”) har publicerat Bolagets delårsrapport för det andra kvartalet 2025. Följande är några punkter som vi valt att belysa i samband med rapporten:
Ingångna avsiktsförklaringar (LOI:er) med internationell räckvidd och betydande potential
Under Q2-25 tecknade AcuCort två strategiskt viktiga avsiktsförklaringar (Letter of Intent, LOI), vilka markerar ett tydligt steg mot ett accelererat internationellt genomslag för Zeqmelit®. Den 10 juni offentliggjordes ett LOI med Lunatus, ett väletablerat läkemedelsbolag baserat i Dubai, avseende distribution och marknadsföring av Zeqmelit® i Mellanöstern och Gulfstaterna. Lunatus, med dokumenterad erfarenhet av framgångsrika lanseringar i partnerskap med globala aktörer, stark närvaro inom AcuCorts målsegment, bred säljkår och välintegrerat distributionsnätverk, erbjuder en kapitaleffektiv väg in på marknader präglade av stark tillväxtdynamik och ökande behov av effektiva behandlingar vid akuta allergiska reaktioner.
Kort därefter, den 17 juni, följde ett andra LOI, denna gång med Glenmark Pharmaceuticals, en global läkemedelskoncern med närvaro i över 80 länder och en årsomsättning om ca 15 mdSEK. Samarbetet omfattar distribution och marknadsföring av Zeqmelit® i sex europeiska länder: Tyskland, Nederländerna, Tjeckien, Österrike, Slovakien och Ukraina. Med en samlad befolkning på över 160 miljoner innebär avtalet en väsentlig expansion av Zeqmelit®s adresserbara marknad. Glenmarks regulatoriska kompetens och breda distributionskapacitet gör bolaget till en stark partner för framtida EU-lanseringar.
Båda LOI:erna utgör initiala steg mot potentiella kommersiella avtal. Även om volym- och intäktsnivåer ännu inte har kommunicerats, ser Analyst Group dessa avtal som tydliga bevis på att Zeqmelit® attraherar intresse från väletablerade och erfarna aktörer. Ett LOI är i regel inte juridiskt bindande, men fungerar som ett ömsesidigt åtagande att förhandla fram ett slutligt avtal där parterna redan är eniga om de centrala villkoren. I Q2-rapporten framhåller Bolaget att diskussionerna intensifierats och att nästa steg är en fördjupad Due Diligence (DD) från båda sidor. Om DD utfaller positivt kan förhandlingarna om slutliga villkor accelerera, varpå vi ser konverteringen till bindande avtal som en av de mest kritiska värdedrivarna under H2-25.
Fortsatt kommersiell etablering för Zeqmelit® i Norden – två nya orders bekräftar starkt momentum
Under Q2-25 mottog AcuCort två nya orders på Zeqmelit® från den nordiska distributionspartnern Unimedic Pharma, vilket understryker det växande marknadsintresset och bekräftar ett starkt kommersiellt momentum. Den första ordern, uppgående till 18,5 tEUR (ca 207 tSEK), markerade inträdet på den danska marknaden och bedöms täcka den initiala lanseringsfasen. Efter kvartalets utgång påbörjades försäljningen till danska apotek, där Bolaget rapporterar ett positivt mottagande – en tidig validering av produktens marknadsrelevans.
Kort därefter erhölls ytterligare en order om ca 60,4 tEUR (ca 675 tSEK), omfattande bredare delar av den nordiska marknaden. Sammantaget utgör dessa orders konkreta indikationer på att Zeqmelit® successivt etablerar acceptans i målgruppen, vilket är särskilt betydelsefullt med tanke på de långa införsäljningscykler som kännetecknar läkemedelsbranschen. Sedan den första ordern under Q1-24 och den efterföljande lanseringen på nordiska apotek under Q3-24 har AcuCort därmed mottagit totalt tre orders. Även om ordervärdena hittills är begränsade, ser vi återkommande beställningar i ett tidigt skede som ett styrkebesked och ett tecken på en växande marknadsposition. Dessutom bekräftas den nordiska marknaden som en strategiskt viktig språngbräda för AcuCorts fortsatta internationella expansion.
Återkoppling från FDA avseende iPSP-ansökan
Som tidigare kommunicerats lämnade AcuCort i slutet av Q4-24 in en Initial Pediatric Study Plan (iPSP) till den amerikanska läkemedelsmyndigheten FDA, ett obligatoriskt steg på vägen mot ett framtida marknadsgodkännande. Den efterföljande 90-dagarsgranskningen har fördröjts till följd av interna processer hos FDA, men under Q2-25 erhöll Bolaget återkoppling på ansökan. AcuCort arbetar nu med att adressera de frågor som myndigheten framfört, vilket bedöms skapa goda förutsättningar inför nästa kritiska steg – inlämnandet av en formell NDA-ansökan (New Drug Application). Förutsatt att inga ytterligare förseningar uppstår från FDA:s sida, estimerar vi att en NDA-ansökan kan lämnas in under slutskedet av 2025, vilket utgör ytterligare en substantiell värdedrivare att bevaka framgent.
Zeqmelit® registrerat som varumärke i Kanada
Under kvartalet meddelade AcuCort att Zeqmelit® har registrerats som varumärke i Kanada, giltigt till år 2033, vilket markerar ett strategiskt viktigt steg i Bolagets pågående internationaliseringsarbete. Varumärkesskyddet i Kanada kompletterar redan befintliga registreringar i bl.a. EU, Storbritannien, USA och Japan, och befäster Zeqmelit®s position som en globalt skyddad produkt. Analyst Group bedömer att det erhållna varumärkesskyddet utgör en tidig milstolpe inför en potentiell lansering på den kanadensiska marknaden, där ett sådant skydd stärker förutsättningarna för långsiktig kommersiell etablering.
Rapporterad nettoomsättning och växande kostnadsbas
Nettoomsättningen uppgick under Q2-25 till 162 tSEK (0), något lägre än ordervärdet från den danska etableringen (18,5 tEUR), vilket indikerar att utfallet primärt hänför sig till denna order. Vi bedömer att den ytterligare ordern under kvartalet, om 60,4 tEUR, väntas materialiseras i resultaträkningen kommande kvartal.
Under Q2-25 uppgick Bolagets totala rörelsekostnader (exkl. avskrivningar) till ca 6,8 MSEK (5,1), vilket motsvarar en ökning om ca 35 % i jämförelse med Q2-24, och en ökning om ca 17 % Q-Q, då rörelsekostnaderna uppgick till ca 5,9 MSEK. Tittar vi närmar på respektive kostnadspost uppgick övriga externa kostnader, vilka utgör Bolagets största kostnad, till 5,1 MSEK (3,7) under Q2-25, en ökning om ca 38 % Y-Y. Personalkostnaderna uppgick till ca 1,7 MSEK (1,4), en ökning om 24 % på årsbasis.
Bolaget noterar att kostnaderna för Q2-25 översteg prognosen, men att H1-25 i sin helhet är i linje med förväntningarna. Framgent förväntas kostnaderna i huvudsak drivas av kommersialiseringen av Zeqmelit®, där fokus ligger på utveckling av produktionsprocesser och regulatoriska aktiviteter. Analyst Group bedömer att kostnadsbasen gradvis kommer att stiga, i takt med att de kommersiella aktiviteterna intensifieras.
Under kvartalet aktiverades utvecklingsutgifter om 1,2 MSEK (1,3), främst hänförliga till stabilitetsstudier, regulatoriskt arbete för godkännande och registrering i Norden och USA, samt utveckling av produktionsprocessen. Avskrivningarna av tidigare aktiverade immateriella tillgångar, som inleddes under Q4-24, uppgick samtidigt till ca 2,1 MSEK under kvartalet.
Solid finansiell position möjliggör offensiva expansionsinitiativ
Vid utgången av Q2-25 uppgick kassan till ca 32,4 MSEK. I samband med kvartalets slut meddelade Bolaget även utfallet av nyttjandet av teckningsoptioner av serie TO2, vilket tillförde AcuCort ca 6,3 MSEK före emissionskostnader. Nettolikviden förväntas erhållas efter kvartalets utgång, vilket innebär att balansräkningen stärkts ytterligare under inledningen av Q3-25. Den förbättrade finansiella ställningen, i spåren av både företrädesemissionen och optionsinlösen, utgör en viktig grund för att driva strategiska dialoger med potentiella licens- och distributionspartners, däribland konvertering av befintliga LOI:s med Glenmark Pharmaceuticals och Lunatus. Samtidigt möjliggör den stärka kassan fortsatta initiativ kopplade till produktion, studier, kommersialisering och regulatoriska aktiviteter.
Den genomsnittliga operativa kapitalförbrukningen under Q2-25 uppgick till ca -1,5 MSEK/månad (-1,6), vilket innebär en viss förbättring jämfört med Q1-25, då den uppgick till ca -2,1 MSEK/månad. Inklusive investeringar uppgick det negativa fria kassaflödet (FCFF) till ca -1,9 MSEK/månad (-2,0). Minskningen förklaras främst av en gynnsam förändring i rörelsekapitalet, vilket kan variera avsevärt mellan kvartal beroende på exempelvis leverantörsutbetalningar och förändringar i kortfristiga tillgångar.
Sammanfattningsvis anser Analyst Group att AcuCorts andra kvartal år 2025 präglades av flera strategiskt viktiga framsteg. Två ingångna LOI:er med Glenmark Pharmaceuticals och Lunatus markerar ett tydligt genombrott för Zeqmelit®s internationella expansion, samtidigt som återkommande orders från Unimedic Pharma bekräftar växande kommersiellt momentum i Norden, med den danska etableringen som en särskild milstolpe. Därtill stärker FDA:s återkoppling på iPSP-ansökan förutsättningarna för en NDA-inlämning mot slutet av år 2025. Sett till det finansiella har kassan stärkts genom företrädesemissionen under H1-25 samt optionsinlösen efter kvartalets utgång, vilket skapar handlingsutrymme för fortsatt kommersialisering och fördjupade partnerskapsdiskussioner. Även om kostnadsbasen gradvis ökar i takt med expansionen, illustrerar Q2-rapporten tydligt att AcuCort befinner sig i ett accelererande kommersiellt skede med flera närliggande värdedrivare.
Vi kommer att återkomma med en uppdaterad aktieanalys av AcuCort.